Д. х. н. Бельтюкова С.В., Бычкова А.А., к.х.н. Малинка
Е.В.
Одесская национальная
академия пищевых технологий, Украина
Определение хлорогеновой кислоты методом
тонкослойной хроматографии с люминесцентным детектированием
Тонкослойная хроматография (ТСХ) занимает
одно из ведущих мест в анализе сложных природных, фармацевтических, медикобиологических
и химических объектов, по производительности превосходит газовую и высокоэффективную
жидкостную хроматографию, использует более простое и дешевое оборудование, обладает
высокой селективностью, которую можно варьировать, подбирая состав подвижной
фазы, дает возможность одновременного разделения нескольких образцов. Использование
люминесцентного детектирования приводит к оптимизации разрешающей способности хроматографической
системы при разделении сложной смеси, увеличению чувствительности и
селективности метода, полученные результаты разделения легко оценить визуально
и количественно.
Нами
разработана методика определения хлорогеновой кислоты методом ТСХ с люминесцентным
детектированием в продуктах растительного происхождения, основанная на
регистрации собственной люминесценции этого препарата в тонком слое сорбента,
усиленной в присутствии ионов иттрия
(ІІІ) и триоктилфосфиноксида (ТОФО).
Хлорогеновая
кислота (ХК) – 1,3,4,5-тетрагидроксициклогексан карбоновая кислота
3-(3,4-дигидроксициннамат), является одним из самых распространенных
фенилпропаноидов среди метаболитов растений и оказывает антиоксидантное,
антиканцерогенное, противовоспалительное и анальгетическое действие. Чаще всего
полифенольные компоненты растительного сырья, в том числе и хлорогеновую
кислоту, определяют методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с
фотодиодным матричным детектированием, а также с помощью обращено-фазовой ВЭЖХ
[1-4]. Эти методы дают возможность одновременного обнаружения флавоноидов в
лекарственных растениях, характеризуются низкими пределами обнаружения
(5-6)∙10-8моль/л. Однако они требуют наличия достаточно
дорогостоящей и сложной аппаратуры.
Этанольный
раствор хлорогеновой кислоты при облучении УФ-светом ртутной лампы с λмакс.=365нм
проявляет люминесцентные свойства, но интенсивность люминесценции (Iлюм.) невелика. Известно,
что Iлюм. лиганда в
некоторых случаях может возрастать при комплексообразовании с ионами металлов,
не имеющих собственного поглощения в видимой области спектра. В связи с этим было рассмотрено влияние на Iлюм. хлорогеновой кислоты
ионов иттрия, лантана, скандия. Наибольшей интенсивностью люминесценции
обладают комплексы с Y (III), который и был выбран для дальнейших исследований.
Ионы Y (III) вызывают увеличение интенсивности люминесценции хлорогеновой
кислоты в этанольной среде в 2 раза.
Спектр
поглощения этанольного раствора хлорогеновой кислоты характеризуется полосой в
УФ-области спектра с λмакс.=335нм с молярным коэффициентом
поглощения ε=23500 л/см·моль, что свидетельствует об интенсивном
поглощении этим лигандом УФ-излучения. При комплексообразовании с ионом Y (III)
полоса поглощения хлорогеновой кислоты сдвигается в видимую область на 35 нм,
максимум поглощения составляет λмакс.=370нм. Батохромное
смещение максимума спектра поглощения хлорогеновой кислоты может служить
подтверждением комплексообразования с ионом Y (III). Характерные изменения при
комплексообразовании наблюдаются и в спектре люминесценции. Спектр
люминесценции комплекса Y (III) с хлорогеновой кислотой имеет максимум с λизл
=515нм и возрастает по интенсивности в 4 раза по сравнению со спектром
люминесценции лиганда.
Интенсивная люминесценция ХК сохраняется
на твердой матрице, в частности, в слое сорбента на хроматографической
пластинке. С целью выбора оптимальных условий и режимов хроматографирования
исследован ряд неподвижных фаз, различающихся по своим свойствам (хроматографические
пластинки Silufol, Sorbfil, СТХ—1А). Наилучшим
оказалось применение хроматографических пластинок марки Silufol. В качестве
подвижных фаз были испытаны следующие индивидуальные растворители и их смеси:
бензол, толуол, хлороформ, этилацетат, уксусная кислота, бутанол, пропанол,
ацетон, этанол, метанол, ацетонитрил, водный аммиак, формамид. В качестве оптимальной
элюирующей системы выбрана следующая: хлороформ – этанол - вода в соотношении 26:16:3.
Изучено
влияние объема пробы (от 0,5 до 3 мкл), наносимого на пластинку, на подвижность
ХК, наилучший результат достигался при нанесении пробы объемом 2 мкл (рис.1).
При меньших и больших количествах пробы пятна на пластинке приобретают
вытянутую форму.
Рис. 1 - Влияние объёма пробы:
а-0,5мкл; б-1мкл; в-2мкл; г-3мкл
Интенсивность люминесценции Iлюм на пятне хроматограммы зависит от
концентрации иона иттрия в проявляющем растворе. Наибольшая интенсивность
люминесценции обнаруживается при использовании раствора хлорида Y (III) с концентрацией 5∙10-3 моль/л.
Наибольшая
интенсивность люминесценции комплекса обнаруживается в нейтральных растворах при pН 6.6 — 7.2. Зависимость сохраняется
и для твердой фазы (рис. 2), поэтому проявление пластинки проводят в присутствии 4 %-ного раствора уротропина.
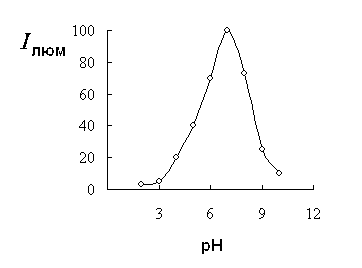
Рис. 2 - Зависимость Ілюм сорбата Y(III)
с ХК от величины рН
Интенсивность люминесценции
сорбата не изменяется в присутствии катионных и анионных ПАВ. Неионное ПАВ
Тритон Х-100 вызывает увеличение интенсивности люминесценции сорбата в 2,5 раза.
Увеличивает интенсивность люминесценции сорбата в 2 раза добавка триоктилфосфиноксида. Установлено, что при добавлении донорно-активной добавки
– триоктилфосфиноксида максимум полосы
поглощения комплекса хлорогеновой кислоты с ионами Y (III) сдвигается еще на 15
нм и составляет λмакс.=385нм, что свидетельствует об образовании
разнолигандного комплекса. Спектр возбуждения хлорогеновой кислоты при
комплексообразовании возрастает по интенсивности, но максимум возбуждения не
смещается и составляет 367 нм. При этом спектр люминесценции комплекса
смещается на 10 нм в сторону длинных волн и максимум люминесценции составляет
λизл.=518нм.
Изучена зависимость интенсивности
люминесценции ХК от концентрации ТОФО в проявляющем растворе. Максимальная
интенсивность люминесценции наблюдается при концентрации ТОФО – 1∙10-3моль/л
и концентрации Тритон Х-100 – 0,1%. Наблюдаемое увеличение интенсивности
люминесценции сорбата в присутствии ТОФО и Тритон Х-100 может быть обусловлено вхождением
молекул ТОФО во внутреннюю координационную сферу центрального иона – иттрия и
вытеснением гидрофильного хлорид-иона, увеличением жесткости люминесцентных
центров под влиянием предмицелл и мицелл неионогенных ПАВ, что способствует
снижению безызлучательных потерь энергии возбуждения за счет ОН-связей молекул
воды.
На основании полученных результатов разработана
методика определения хлорогеновой кислоты в различных овощах и яблоках: пластинки «Силуфол УФ 254» 15х15
см перед использованием активировали в сушильном шкафу при 100-105°С в течение
1 часа. На линию старта пластинки наносили
микропипеткой около 0,02 мл исследуемого образца и стандартного раствора
хлорогеновой кислоты (1∙10-4 моль/л). Хроматографическую
пластинку помещали в камеру, которую предварительно насыщали не менее 1 ч смесью растворителей: хлороформ –
этанол - вода (26:16:3), хроматографировали восходящим способом. Когда фронт
растворителей проходил около 13 см, пластинку вынимали из камеры, сушили на
воздухе в течение 5 мин, проявляли растворами хлорида Y
(III), ТОФО, Тритона X -100 и просматривали в УФ-свете при длине волны
λвозб.=365нм. Пятна, соответствующие хлорогеновой кислоте (Rf
0,2), которые светились зелёным светом, вырезали из пластинки и регистрировали Ілюм на спектрометре СДЛ -1 в кювете
для твёрдых образцов. Определение проводили методом градуировочного
графика. Результаты определения представлены в таблице1.
Таблица 1
Результаты
определения хлорогеновой кислоты в растительных продуктах
|
Наименование
продукта |
Найдено,
мг/г |
Sr |
|
Морковь корнеплоды |
0,27 |
0,010 |
|
Свекла корнеплоды |
0,30 |
0,028 |
|
Капуста белокочанная |
0,05 |
0,041 |
|
Капуста
краснокочанная |
0,20 |
0,030 |
|
Яблоко цельное |
0,15 |
0,015 |
Результаты определения проверены методом
«введено-найдено» и показана правильность разработанной методики. Предел
обнаружения хлорогеновой кислоты составляет 0,05 мкг/мл.
Литература:
1. Правдивцева О.Е., Куркин В.А.
Исследования по обоснованию новых подходов к стандартизации сырья и препаратов
зверобоя продырявленного // Химия раст.
сырья –– 2008. –– № 1. –– С. 81 –– 86.
2. Жукова О.Л., Абрамов А.А. Изучение фенольного состава подземных
органов сабельника болотного // Вестн. Моск. Ун – та. –– 2006. –– Т. 47.
–– № 5. –– С. 342 ––
345.
3. Бенетис Р., Радушене И. Количественное
определение фенольных соединений в лекарственном сырье тысячелистника обыкновенного
методом ВЭЖХ // Хим.-фарм. журн. ––
2008. –– Т. 42. –– № 3. –– С. 51 –– 58.
4. Алексеева
М.А., Эллер К.И. Определение
полифенольных компонентов хмеля с помощью обращенно – фазовой ВЭЖХ // Хим. – фарм. журн. –– 2004. ––
Т. 38. –– № 12. –– С. 39 –– 41.