Барковская Д.В. , Звягинцева А.В.
Воронежский государственный технический университет, Воронеж, Россия
Коррозионно-электрохимические исследования разрушений
трубопроводов нефтегазового комплекса
Нефтегазоносный
комплекс представляет объекты повышенного экологического
риска, который возникает в результате аварий на техногенных объектах
[1]. Цель данной работы: для
повышения безопасности эксплуатации нефтескважин, ёмкостей и нефтепровода -
определение скорости коррозии трубной стали без ингибиторов и в их
присутствии в модельных растворах, имитирующих пластовую воду в нефти на Волжско-Уральском нефтегазодобывающем
комплексе. Нефть Поволжья содержит 7—11%
парафина, 12—20% смол, значительный процент легких углеводородов и отличается
повышенным содержанием серы 3—3,5%. Пластовые воды нефтяных месторождений
высоко минерализованная среда с содержанием солей до 300 г/л являются
коррозионным агентом. Наиболее распространенной (91%) является
внутренняя коррозия, 71% из которой составляет канавочная коррозия. На рис.1. представлена схема
формирования очагов «канавочной» коррозии. В трубопроводе формируется
коррозионный гальванический элемент (ΔЕ =
200мВ), в котором анодом является материал трубы, которой коррозируя, образует трещины и происходит ее разрушение.
Очаги канавочной коррозии имеют вид прямоугольной канавки шириной до 5 см и
длиной до 10-12 м, расположенной в области нижней образующей трубы.
Коррозионные испытания проводили в растворе,
имитирующим пластовую воду, в состав которого входил NaCl и Na2SO4 при общей минерализации 50 мг/дм3. В качестве исследуемого
материала использовали сталь 40Х. Методика эксперимента описана в работе [1,2].
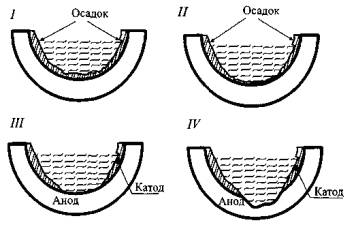
Рис.1. Основные стадии
формирования очагов «кановочной» коррозии
На рис.2. представлены поляризационные
потенциодинамические Е-i кривые, полученные на стали в 3%-ном растворе NaCl и в пластовой воде. Видно, что с большей скоростью
процесс ионизации железа (основной компонент стали) происходит в 3% растворе NaCl (кр.1), чем в пластовой воде (кр.2). Например, при
Е=-0,3 В плотность тока i = 1,8 мА/см2 для раствора
NaCl, и 0,2 мА/см2 – для пластовой воды, что очевидно
связано с активирующим действием Cl- - ионов (с их повышенной концентрацией в
растворе NaCl), которые активнее разрушают
оксидную пленку на поверхности железа.
Процесс коррозии железа в обоих растворах можно представить в виде
схеме:
А(-): Fe – 2e = Fe2+
K(+): O2 + 2H2O + 4e =
4OHֿ
Из этого следует, что
в нейтральной солевой среде железо
коррозирует с кислородной деполяризацией.
Результаты
поляризационных потенциодинамических Е-i кривые, полученные на стали в
3%-ном растворе NaCl и в пластовой воде показали,
что с большей скоростью процесс
ионизации железа (основной компонент стали) происходит в 3% растворе NaCl, чем в пластовой воде. Из данных анодных поляризационных исследований следует, что скорость
коррозионного тока iкорр. = 0,13 мА/см2 в 3%
растворе NaCl, масса растворенного железа в соответствии с законом Фарадея составляет
0,041 мг и при S = 1см2 скорость коррозии Vкорр. = 0,041 мг/см2·час. Электрохимическими
исследованиями в пластовой воде было
установлено, что iкорр. = 0,03 мА/см2, а
скорость коррозии Vкорр. = 0,009 мг/см2·час. В
пластовой воде, входящий в состав нефти, наблюдается коррозия стали 40Х с
кислородной деполяризацией. Полученные данные при электрохимических измерениях
согласуются с результатами гравиметрических коррозионных испытаний, проведенных
при определении потери массы образцов в солевой среде без протектора V = 0,036 мг/см2час и в пластовой воде Vкор = 0,0059 мг/см2час.
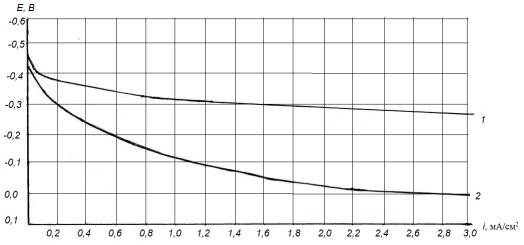
Рис.2. Потенциодинамические Е-i кривые
стали 40Х в 3% растворе NaCl (1) и пластовой воде (2)
Результаты эксперимента показали, что защитное действие Mg-протектора достаточно эффективно в солевой среде и
пластовой воде, но при этом в менее агрессивной пластовой воде Mg-протектор защищает в большей степени. Определенным недостатком Mg-протектора является то, что в процессе работы коррозионной пары А(-) Mg |NaCl, H2O| Fe К(+), он как более активный металл коррозирует с водородной
деполяризацией:
A(-): Mg - 2e- = Mg2+
K(+): 2H2O
+ 2e = H2 + 2OHֿ .
В процессе работы этого коррозионного элемента
выделяющийся газообразный водород, может накапливаться в нефти и снижать
безопасность эксплуатации нефтяных
трубопроводов. В таблице 1 показан
расчёт экономической эффективности применения протекторной защиты и ингибиторной защиты от коррозии стали 40Х
нефтяного трубопровода от коррозии в пластовой воде.
Таблица 1. Экономическая
эффективность протекторной и ингибиторной защиты стали 40Х от коррозии в
пластовой воде.
|
Защита:
протектор,
ингибитор |
Потеря массы металла, кг/год |
Стоимость потерь металла, руб/год |
Экономическая эффективность, руб/год |
|
Mg |
228 |
34200 |
44300 |
|
Zn |
140,5 |
66056 |
14094 |
|
уротропин |
60 |
4700 |
78800 |
В качестве
рекомендации по повышению эффективности
защиты стали 40Х нефтяных трубопроводов от внутренней коррозии является
использование протекторной защиты с применением Mg в качестве протектора и применение ингибиторов коррозии – уротропина и
совершенно очевидно, необходим поиск новых оптимальных решений по защите
от коррозии трубопроводов. В заключении
можно отметить, что необходим поиск новых оптимальных решений по защите от коррозии трубопроводов.
литература:
1. Д.В. Барковская, А.В.
Звягинцева. Особенности проведения инженерно-технических мероприятий по
повышению безопасности при эксплуатации техногенных объектов /Машиностроение и
техносфера XXI века //Сборник трудов XVIII международной научно-технической конференции. Донецк:
ДонНТУ. 2011. Т.1. С. 69 – 75.
2. Д.В. Барковская,
С.С.Беломыльцева, А.В. Звягинцева. Электрохимические исследования для снижения
коррозионного износа внутренней поверхности трубопроводов объектов техносферы /Инженер.
Студенческий научно-технический журнал. Донецк: ДонНТУ. 2011. №12. С.166 – 168.