Вопросам диффузии водорода в электролитических
покрытиях уделяется особое внимание в работах ряда авторов [1,2]. Интерес к
этой проблеме обусловлен необходимостью экстракции водорода из электролитических
металлов для устранения водородной хрупкости покрытий. При диффузии водорода
под действием температуры становится вероятным процесс дезинтеграции отдельных
атомов с образованием молекул с последующим слиянием их в агрегацию (пузырек
водорода). Транспорт (диффузия) таких молекулярных структур сопряжен с рядом
особенностей, а именно отдельные агрегации могут перемещаться в каналы
закрытого типа с невозможностью их выхода за пределы образца. По-видимому, это
является основной причиной несовпадения результатов эксперимента, проводимым
методом вакуумной экстракции и вакуумного плавления.
Основополагающие работы по теории
процессов выделения ![]() и
и ![]() на электродах из
различных материалов были проведены А.Н. Фрумкиным с сотрудниками [3]. Основное
влияние на процесс газовыделения на электродах оказывает катодное восстановление
на электродах из
различных материалов были проведены А.Н. Фрумкиным с сотрудниками [3]. Основное
влияние на процесс газовыделения на электродах оказывает катодное восстановление
![]() и анодное окисление
молекул
и анодное окисление
молекул ![]() и ионов
и ионов ![]() . Главная задача – увеличение интенсивности газовыделения –
сводится к уменьшению перенапряжений выделений
. Главная задача – увеличение интенсивности газовыделения –
сводится к уменьшению перенапряжений выделений ![]() и
и ![]() на электродах (
на электродах (![]() и
и ![]() ).
).
Немаловажное влияние на процессы восстановления
![]() и окисления
и окисления ![]() и
и ![]() ионов оказывает
природа материала электродов. Величина
ионов оказывает
природа материала электродов. Величина ![]() связана линейной зависимостью
с величиной плотности тока (
связана линейной зависимостью
с величиной плотности тока (![]() ) известным уравнением Тафеля [3]:
) известным уравнением Тафеля [3]:
![]() (1)
(1)
Постоянная, а характеризует степень необратимости
процесса на электроде. В работе [3] была установлена зависимость между
постоянной и коэффициентом сжимаемости металла (![]() ):
):
![]() (2)
(2)
Графическое изображение формулы (2)
представлено рис. 1.
Анализ этой зависимости дает возможность
осуществить оптимальный выбор материала электрода с точки зрения водородного и
кислородного перенапряжения. При сопоставлении величин ![]() с минимальным межатомным
расстоянием
с минимальным межатомным
расстоянием ![]() установлено [3], что
минимальное значение
установлено [3], что
минимальное значение ![]() соответствует
расстоянию 2,7 А0, а у металлов с большим или меньшим значением
соответствует
расстоянию 2,7 А0, а у металлов с большим или меньшим значением ![]() величина
величина ![]() возрастает. Точное
значение
возрастает. Точное
значение ![]() зависит от
физического состояния поверхности электрода.
зависит от
физического состояния поверхности электрода.
Температура электрода значительно
отличается от температуры электролита за счет различных тепловых эффектов, то
необходимо учитывать влияние температуры на величины ![]() и
и ![]() . Количественная оценка этого влияния может быть выражена
формулой:
. Количественная оценка этого влияния может быть выражена
формулой:
![]() (3)
(3)
где ![]() - доля тока.
- доля тока.
Так как ![]() , то температурный коэффициент перенапряжения по своей абсолютной
величине больше при малых плотностях тока и меньше при высоких. Исходя из
этого, следовало ожидать, что при дегидротации иона
, то температурный коэффициент перенапряжения по своей абсолютной
величине больше при малых плотностях тока и меньше при высоких. Исходя из
этого, следовало ожидать, что при дегидротации иона ![]() поглощаемая энергия
будет создавать в зоне реакции отрицательный градиент температуры, облегчая
транспорт ионов
поглощаемая энергия
будет создавать в зоне реакции отрицательный градиент температуры, облегчая
транспорт ионов ![]() (H+ + H2O → H3O+ + 1110 кДж) в зону реакции.
(H+ + H2O → H3O+ + 1110 кДж) в зону реакции.
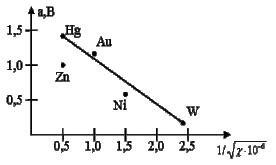
Рис.1. Значения перенапряжения выделения ![]() для различных
металлов при плотностях тока i = 1 А/см2
для различных
металлов при плотностях тока i = 1 А/см2
Однако, подобное явление не наблюдается в
силу нескольких причин. В приэлектродной зоне наиболее вероятным процессом
является дезинтеграция атомов водорода с образованием молекул. Эта реакция сопровождается
выделением тепла, поэтому она частично компенсирует поглощение тепловой энергии
в результате дегидротации иона гидроксония. Другим компенсирующим компонентом
может быть энергия хемосорбции ионов при взаимодействии их с поверхностью
металлов, которая аналогичным образом вызывает термодиффузию ионов водорода
вглубь раствора электролита.
Анализируя зависимость перенапряжения от
природы металла нетрудно установить, что Ni, имея незначительную величину перенапряжения, может
активно взаимодействовать с атомарным водородом, образуя гидридные соединения.
Кроме того, протонированный водород, имея весьма ограниченные размеры (~10-5
А0) способен проникать внутрь кристаллической решётки на
относительно большие расстояния и восстанавливаться на любом из возможных дефектов с высоким энергетическим уровнем.
Из результатов эксперимента (рис. 2) следует,
что с увеличением ik от 0,5 до 4,0
А/дм2 относительное содержание водорода в покрытии Ni-B уменьшается [4].
Экспериментальные данные показывают, что методом экстракции не происходит полного
удаления водорода из образцов толщиной
15 мкм в связи с наличием ловушек, не имеющих открытого выхода к поверхности
электрода.
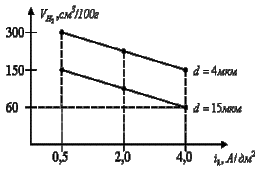
Рис. 2. Зависимость содержания водорода в
покрытии Ni-B от ik
Наибольшей достоверностью обладают
результаты, полученные для тонких образцов (4мкм), для которых плотность таких
дефектов несколько ниже из-за ограниченной длины транспортного канала. Это
подтверждает также результаты определения экстракции водорода методом
плавления.
Выводы
1. Концентрация водорода в электролитическом
осадке имеет случайный характер и определяется вероятностью образования дефектных
структур в металле.
2. Энергия связи металл-водород зависит от
потенциала образующегося дефекта и, по-видимому, её разброс лежит в
достаточно широком диапазоне значений.
Этот факт определяет величину температуры экстракции водорода из структуры
металла.
Литература:
1. Наводораживание металлов в электролитах /В.В.
Кузнецов, Г.В. Халдеев, В.И. Кичигин.
М.: Машиностроение, 1993. 244 с.
2. A.V. Zvyaginseva, Y.N. Shalimov. Laws of diffusion of hydrogen in electrolytic alloys on the basis of nickel /Carbon Nanomaterials in Clean Energy Hydrogen Systems. Springer. 2011. P. 529 –
534.
3. Фрумкин А.Н. Электродные процессы. Избранные труды. М.: Наука, 1987. 336 с.
4. A.V. Zvyagintseva. Interaction peculiarities of hydrogen and
Ni-B galvanic alloys /Carbon
Nanomaterials in Clean Energy Hydrogen Systems. Springer. 2008. P. 437 – 442.