Химия
и химические технологии/6.Органическая химия
Аспирант Слащинин
Д.Г., д.х.н. Товбис М.С.
Сибирский
государственный технологический университет, Россия
Изучение реакции ацилирования новых
перзамещенных пара-нитрозофенолов
Существует
ряд полностью замещенных пара-нитрозофенолов, которые, в
отличие от остальных нитрозофенолов, в
виде калиевых солей находятся в мономерной нитрозоформе, а в свободной
нитрозофенольной форме они димеризованы [1-2]. При
их гидрировании образуются соответствующие п-аминофенолы [3]:
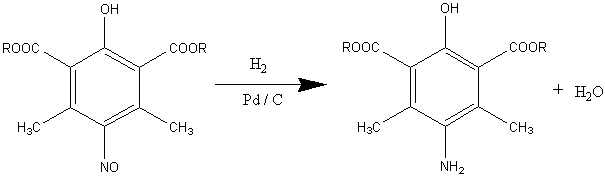
где R = Me, Et, Pr, Bu
Некоторые производные таких
перзамещенных аминофенолов нашли применение в химико-фармацевтической
промышленности в качестве противоаритмических препаратов [4].
В ходе изучения химических свойств полностью
замещенных пара-нитрозофенолов нам
удалось проацилировать калиевые соли
2,6-диалкоксикарбонил-3,5-диметил-4-нитрозофенола уксусным ангидридом и
хлористым бензоилом, В результате во всех случаях были получены
кристаллические продукты алкилирования желтого цвета, с выходом до 90 %. Строение продуктов подтверждено методами ЯМР
1Н спектроскопии и масс-спектрометрии.
Во всех ЯМР 1Н
спектрах протоны метильных групп кольца и протоны сложноэфирных заместителей
оказались неэквивалентными из-за син-анти расположения по отношению к ацилоксимной
группе. По этой причине сигналы протонов всех указанных групп были «двойными» и
имели одинаковую интенсивность. В то же время сигналы протонов ацильного
заместителя при оксимной группе не удвоены. Это наглядное подтверждение того,
что ацилирование во всех случаях идет по атому кислорода нитрозогруппы. В
результате мы впервые выделили 10 новых 1-ацетоксимино- либо 1-бензоилоксимино-3,5-ди(алкоксикарбонил)-2,6-диметил-1,4-бензохинонов:
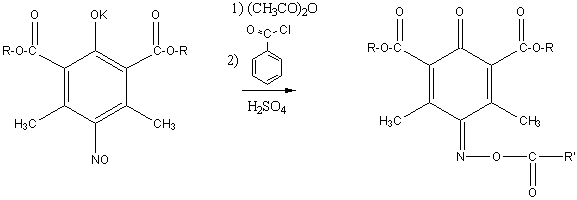
где R = Me, Et, Pr,
Bu, Am; R’ = СH3, C6H5
На рисунке 1 представлен ЯМР 1Н
спектр одного из продуктов бензоилирования: 1-бензоилоксимино-3,5-ди(амилоксикарбонил)-2,6-диметил-1,4-бензохинона
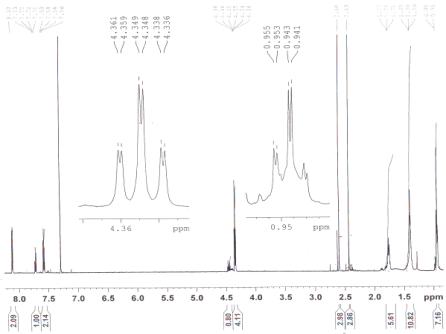
Рисунок 1 – ЯМР 1Н спектр 1-бензоилоксимино-3,5-ди(амилоксикарбонил)-2,6-диметил-1,4-бензохинона.
В спектре четко видны сигналы
протонов ароматического кольца бензоильного заместителя в слабом поле, с
химсдвигом δ=8.1 м.д. для двух протонов в орто-положении, одного
протона в пара-положении с химсдвигом δ=7.72 м.д. и двух протонов в
мета-положении с химсдвигом δ=7.58 м.д. В спектре также
присутствуют сигналы протонов пентильных заместителей сложноэфирных групп:
четыре протона метиленовых групп, которые находятся у атома кислорода в виде
триплета, в более слабом поле, с химсдвигом δ=4.34 – 4.36 м.д. (триплет
«двоится» из-за син- либо анти-
расположения по отношению к ацилоксимной группе); шесть протонов
метильных групп в сильном поле в виде «удвоенного» триплета с химсдвигом
δ=0.95 – 0.96 м.д.; остальные протоны метиленовых групп в виде
мультиплетов в области δ=1.39 – 1.74 м.д. Сигналы шести протонов метильных
групп кольца выходят в области δ=2.43 м.д. и δ=2.60 м.д. в виде
«удвоенных» синглетов.
Таким образом, были впервые проацилированы
гексазамещенные пара-нитрозофенолы и получен ряд ацетильных и
бензоильных производных по атому кислорода нитрозогруппы, а не по атому
кислорода гидроксигруппы.
Литература:
1. Сёмин
И.В., Соколенко В.А., Товбис М.С. Журнал органической химии. 2007. 43. 545-548.
2. Алемасов Ю.А., Слащинин Д.Г.,
Товбис М.С., Кирик С.Д. Журнал Сибирского федерального университета. Химия.
2010. Том 3. №1. С. 45-57.
3. Слащинин
Д.Г., Товбис М.С., Роот Е.В., Задов В.Е., Соколенко В.А. Журнал органической
химии. 2010. 46. 527-529.
4. Eiden F., Leister H.P., Mayer D. Arzneimittel-Forschung.
1983. 33. 101-105.