Химия и химические
технологии/6.Органическая химия
Аспирант Слащинин Д.Г., к.х.н.
Любяшкин
А.В., асп. Федорова Н.А.,
д.х.н. Товбис М.С.
Сибирский
государственный технологический университет, Россия
Получение перзамещенных амидов
5-нитрозоизофталевой кислоты
Известен способ получения полностью
замещенных эфиров изофталевой кислоты циклизацией диалкиловых эфиров
ацетондикарбоновой кислоты (АДК) с изонитрозо-β-дикетонами [1-2]:
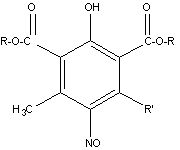
где R = CH3; C2H5; C3H7;
C4H9; i-C4H9; i-C5H11
R’ = CH3; C2H5;
Ph; p-Сl-Ph; p-CH3O-Ph
Такие перзамещенные нитрозопроизводные
легко гидрируются, приводя к гексазамещенным аминопроизводным [3], обладающим
биологической активностью [4]. Производное одного из них – диэтиловый эфир
5-амино-2-гидрокси-4,6-диметилизофталевой кислоты – является антиаритмическим
препаратом [5]. Однако до сих пор других перзамещенных производных 5-нитрозоизофталевой
кислоты не было получено. Поэтому целью нашей работы стала попытка получения
5-нитрозоизофталевой кислоты, содержащей фениламидные группировки вместо
сложноэфирных.
Для достижения указанной цели мы
исследовали реакцию циклизации изонитрозоацетилацетона с фениламидами АДК, которые
получали по схеме:
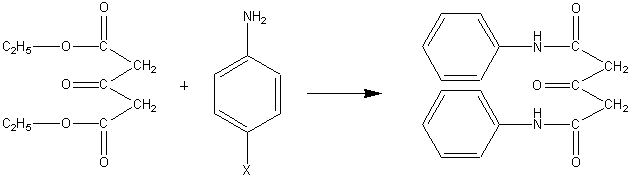
где Х = Н, п-
ОСН3
Получение амидов проводили двумя
способами: нагреванием смеси анилина с диэтиловым эфиром АДК в запаянной ампуле
при 100 ºС, 24 часа на водяной бане, без растворителя [6] и с
триэтиламином в течение 1 часа при 130 – 150 ºС [7]. Т. пл. дианилида АДК 155
ºС, ди-п-анизидида АДК 57
ºС. что соответствует литературным данным.
Следует отметить, что в публикациях [6-7]
ни спектральных данных, ни каких-либо свойств, кроме температуры плавления
приведено не было. Поэтому мы записали ЯМР 1Н спектры
синтезированных диамидов АДК в ДМСО d-6. В
спектре дианилида АДК присутствуют сигналы орто-,
мета- и пара-протонов анилинового
кольца с химсдвигами 7,57 м.д., 7,33 м.д. и 7,09 м.д., синглет протонов
метиленовых групп в области 3,71 м.д., протон аминогруппы в области 10,2 м.д. В
спектре ди-п-анизидида АДК
присутствуют сигналы орто- и мета- протонов анизидинового кольца с
химсдвигами 6,89 м.д. и 7,49 м.д., синглет протонов метиленовых групп в области
3,73 м.д., протон аминогруппы в области 10,1 м.д. и протоны метоксигрупп в
области 3,7 м.д. в виде синглета. Из-за кето-енольной таутомерии оба спектра
усложняются, появляется сигнал протонов енольного гидроксила в области 13,88
м.д., это приводит к расщеплению сигналов метиленовых групп и аминогрупп.
Полученные диамиды АДК ввели в реакцию
циклоконденсации с изонитрозоацетилацетоном (ИНАА) в спиртовом растворе
калиевой щелочи в условиях, аналогичных [1-2]. Получали зеленые кристаллы
калиевой соли дианилидов 5-нитрозо-2-гидрокси-4,6-диметилизофталевой кислоты:
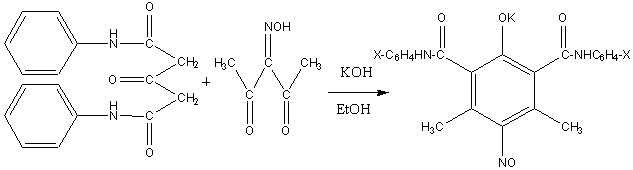
где Х = Н, п-ОСН3
При подкислении полученных калиевых солей выпадали светло-желтые кристаллы димерных
нитрозосоединений. В ЯМР 1Н спектрах перзамещенного нитрозофенола с
фениламидными группами присутствуют сигналы ароматических протонов с химсдвигами
в области 7,1-7,6 м.д., а также сигналы трех различных метильных групп
ароматического кольца в области 2,3-2,5 м.д. Метильные группы становятся
неэквивалентными, вероятно, из-за образования нитрозодимеров.
Литература:
1.
Сёмин И.В., Соколенко
В.А., Товбис М.С. Журнал органической химии. 2007. 43. 545-548.
2.
Alemasov Yu.A., Slaschinin D.G., Tovbis M.S., Kirik S.D. Journal of
Molecular Structure, 2011. 985.184-190.
3.
Слащинин Д.Г., Товбис
М.С., Роот Е.В., Задов В.Е., Соколенко В.А. Журнал органической химии. 2010.
46. 527-529.
4.
Слащинин Д.Г.,
Коростелева Н.С., Перьянова О.В., Котловский Ю.В., Товбис М.С. 11-ая Международная конференция «Актуальные проблемы
современной науки». Самара 2010. Часть 8. Органичесая химия. С. 9-11.
5. Eiden
F., Leister H.P., Mayer D. Arzneimittel-Forschung. 1983. 33(1). 101-105.
6. Besthorn E., Garben
E. Berichte der dentschen chemisches Gesellschaft. 1903. 33. 3435.
7. Mohamed I. Ali, El-Morsy
Mohamed M. S. Journal f. prakt. Chemie. 1979. 321. Helf 6. 1047-1052.