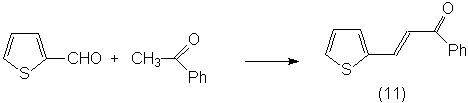ОКИСЛИТЕЛЬНОЕ
ПРИСОЕДИНЕНИЕ N-АМИНОФТАЛИМИДА
К ПРОИЗВОДНЫМ ТИОФЕНА
© А.Н.Бландов,
М.К.Янайте @
Санкт-Петербургский
государственный университет,
198904,
Санкт-Петербург, Университетский пр., д. 2,
е-mail: mak@org.chem.lgu.spb.su
Тиофен
проявляет низкую реакционную способность в реакции окислительного присоединения
N-аминофталимида – эта реакция в основном приводит к
фталимиду, образование которого характерно для малореакционных субстратов.
Однако в реакционной смеси был обнаружен продукт, имеющий симметричную
структуру и образовавшийся в результате присоединения сразу 2 моль
азиридинирующего реагента по обеим связям тиофенового кольца. Производные
тиофена с акцепторными заместителями – альдегидной, сложноэфирной и амидной
группами оказываются нереакционноспособными, и единственным продуктом
оказывается фталимид. Реакция с 2-метилтиофеном протекает с осмолением, и
индивидуальных продуктов выделить не удается.
Окислительное
фталимидоазиридинирование ненасыщенных производных тиофена – тиенальацетона,
тиенальацетофенона, этилового эфира и диэтиламида 3-(2-тиенил)акриловой кислоты
с хорошими выходами приводит к продуктам присоединения 1 моля азиридинирующего
реагента только по экзоциклической двойной связи С=С без участия в реакции
тиофенового кольца. Полученные соединения являются первыми представителями
неописанного ранее класса азиридинилтиофенов.
Современная органическая химия уделяет
большое внимание химии малых циклов. Одним из перспективных направлений в этой
области является синтез азиридинов. На сегодняшний день разработано
значительное число препаративных методов синтеза соединений, содержащих
азиридиновое кольцо, одним из которых является окислительное присоединение N-аминогетероциклов к ненасыщенным субстратам. Такую
реакцию называют окислительным аминоазиридинированием [1-3]:
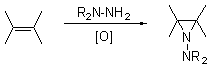
В
последние годы было изучено поведение в реакции фталимидоазиридинирования
различных пятичленных гетероциклических систем – фуранов и бензофуранов,
пиразолинов и пиразолов, 1,3,4- и 1,2,4-оксадиазолов и их непредельных
производных. При этом было показано, что лишь фурановое кольцо способно
непосредственно взаимодействовать с азиридинирующим реагентом, тогда как в
остальных случаях присоединение может протекать лишь по экзоциклическим двойным
связям. Однако в литературе почти ничего неизвестно о реакционной способности в
этой реакции тиофенового кольца. Лишь недавно в нашей лаборатории был описан
единственный пример присоединения фталимидонитреноида к ненасыщенному
производному тиофена, содержащему пиразолиновый цикл [4]:
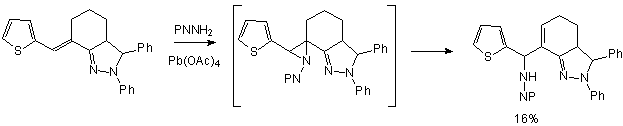
При этом в реакцию вступило не тиофеновое кольцо, а
сопряженная с ним двойная связь, причем получившийся азиридин оказался
неустойчивым и сразу перегруппировался в непредельный фталоилгидразин. Однако
неизвестно, насколько общим является такой тип протекания реакции, и для самого
тиофена и его простейших производных все же нельзя исключать возможность
реакции тиофенового кольца, подобно производным фурана. Хотя энергия
ароматической стабилизации тиофенового кольца (28,7 ккал/моль) значительно
больше, чем у фуранового (15,8 ккал/моль), и вероятность реакций с разрушением
ароматической системы меньше, но она все же существует.
В
качестве объектов фталимидоазиридинирования нами были взяты коммерчески
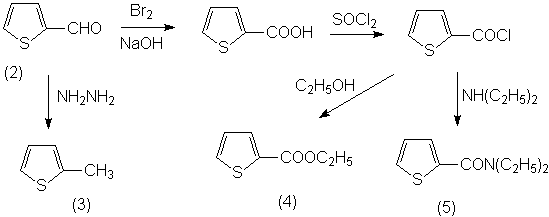
доступные тиофен (1) и тиофен-2-карбальдегид (2). Синтез остальных производных
тиофена осуществлялся из тиофен-2-карбальдегида, который был восстановлен по
Кижнеру-Вольфу в 2-метилтиофен (3), а также окислен в тиофен-2-карбоновую
кислоту, из которой через стадию хлорангидрида были получены этиловый эфир (4)
и диэтиламид (5):
Было установлено, что при взаимодействии
фталимидонитреноида с соединениями (2), (4), (5), согласно спектрам ПМР
реакционных смесей, продукта присоединения не образуется, а происходит только
образование фталимида – обычного побочного продукта в случае малореакционноспособных
соединений. Это может быть связано с наличием акцепторных заместителей, которые
понижают реакционную способность, например, у бензольного кольца и также у
тиофенового цикла. Однако, при проведении реакции с самим тиофеном в спектре
ПМР реакционной смеси наблюдался сигнал, отвечающий возможному продукту
присоединения – АВ-система (а точнее, система АА`BB`) при 4,0-4,2 м.д. с константой 5,5 Гц, т.е. в
области, характерной для азиридиновых протонов. При этом отсутствовали сигналы
в области олефиновых протонов, и наблюдался мультиплет фталоильных протонов при
7,6-7,8 м.д. Это говорит о том, что произошло присоединение сразу 2 моль
азиридинирующего реагента с образованием бис-азиридина, имеющего симметричную
структуру. Вероятнее всего, присоединение происходит с разных сторон
тиофенового цикла с образованием транс-изомера:
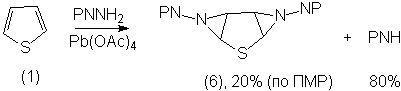
Это же подтверждает и спектр ЯМР 13С,
в котором в области алифатических атомов углерода наблюдались лишь 2 сигнала
при 52,2 и 54,2 м.д., которые соответствуют азиридиновым атомам углерода. В
спектре отсутствуют сигналы каких-либо других форм, что говорит о его
существовании в виде единственного инвертомера. Полученный продукт находится в
смеси с фталимидом в соотношении примерно 1:4. Нам, к сожалению так и не
удалось выделить его в чистом виде, поскольку при перекристаллизации и при
хроматографировании на силикагеле в хлористом метилене он разлагается. Поэтому
окончательно структуру его мы не можем считать доказанной. Учитывая, что
донорные заместители обычно повышают реакционную способность ароматической
системы (например, бензольного кольца), мы также ввели в реакцию 2-метилтиофен (2),
полученный восстановлением альдегида по Кижнеру-Вольфу. В этом случае
образования фталимида не наблюдалось, однако происходило значительное осмоление
реакционной смеси, и выделить из нее индивидуальных продуктов не удалось. Таким
образом, реакция с фталимидонитреноидом, по-видимому, протекает, но дает
нестабильные продукты.
Кроме
этого, мы решили изучить и ряд ненасыщенных производных тиофена. В качестве
исходных были выбраны этиловый эфир (7) и диэтиламид (8) 2-тиенилакриловой
кислоты, полученные последующей схеме:
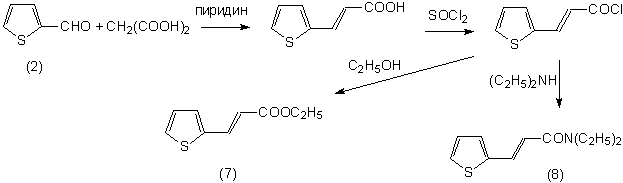
Тиофен-2-карбальдегид
мы ввели в реакцию Кневенагеля с малоновой кислотой, затем из полученной
3-(2-тиенил)акриловой кислоты был синтезирован её хлорангидрид, а из него –
этиловый эфир (7) и диэтиламид (8) 3-(2-тиенил)акриловой кислоты.
Кроме
того, тиофен-2-карбальдегид был введен в реакцию конденсации с ацетоном и в
зависимости от соотношения реагентов получены тиенальацетон (9) и дитиенальацетон (10):
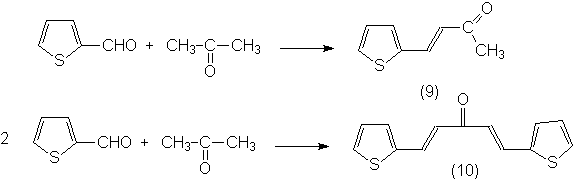
Также были получены продукты конденсации
тиофен-2-карбальдегида с ацетофеноном и нитрометаном:
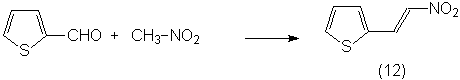
В реакциях фталимидонитреноидов с
соединениями (7) и (8) были получены продукты присоединения по экзоциклическим
связям, строение которых было установлено по спектрам ПМР и ЯМР 13С
и подтверждено элементным анализом:
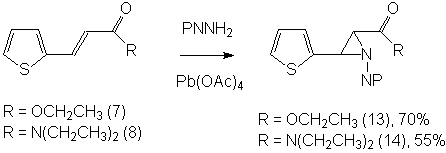
В спектрах ПМР обоих полученных азиридинов
наблюдаются сигналы двух инвертомеров, присутствующих в соотношении примерно
1:4. Это пары дублетов в области, характерной для азиридиновых протонов (от 3.5
до 5.0 м.д.) с константами спин-спинового взаимодействия, характерными для
транс-расположения азиридиновых протонов (5.3-6.2 Гц). Видны также два
комплекта сигналов тиофенового кольца, этильных групп, которые, как и в
исходном соединении (8) являются диастереотопными, и мультиплеты
фталоильных протонов. Также в спектрах ЯМР 13С наблюдаются две пары
сигналов азиридиновых атомов углерода при 45-50 м.д., сигналы атомов углерода фталоильного
фрагмента, тиофенового кольца и диастереотопных этильных групп.
Далее мы изучили фталимидоазиридинирование
других ненасыщенных производных с карбонильной функцией – тиенальацетона (9),
тиенальацетофенона (11), дитиенальацетона (10), и 2-(2-нитровинил)тиофена (12).
При этом в случае тиенальацетона (9) и тиенальацетофенона (11) с хорошими
выходами были получены продукты присоединения по экзоциклическим двойным связям
(15) и (16):
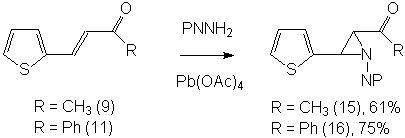
В их спектрах ПМР наблюдаются два
комплекта дублетов в области азиридиновых протонов (3.7-5.3 м.д.) с константой
5,1 Гц, характерной для транс-расположения азиридиновых протонов, и с
соотношением интенсивностей сигналов инвертомеров ~1:5. Также наблюдаются два
комплекта сигналов тиофеновых колец и мультиплет фталоильных протонов. Кроме
того, в спектре соединения (15) видны два сигнала метильных групп обоих
инвертомеров, а в спектре (16) – двойной комплект сигналов монозамещенного
бензольного кольца. Также в спектрах ЯМР 13С наблюдаются две пары
сигналов азиридиновых атомов углерода при 45-53 м.д., сигналы атомов углерода
фталоильного фрагмента, тиофеновых циклов, кетонных групп (при 190-200 м.д.) и
соответственно метильной группы и бензольного кольца. Следует заметить, что
азиридин (15) термически весьма нестабилен и разлагается при попытках
перекристаллизации из спирта и других растворителей, и его очистка возможна
только переосаждением, например, гексаном из эфира. В связи с этим, нам не
удалось достичь удовлетворительной сходимости данных элементного анализа с
расчетом, и структура полученного продукта дополнительно подтверждена
масс-спектром, в котором присутствует
сигнал молекулярного иона с m/z=312, а основной осколочный ион с m/z=270
соответствует потере ацетильной группы. Напротив, азиридин (16) может быть
легко очищен перекристаллизацией из спирта без разложения. Реакции с
дитиенальацетоном и 2-(2-нитровинил)тиофеном к успеху не привели – в этих
случаях наблюдалось значительное осмоление в реакционных смесях, и выделить
индивидуальные продукты нам не удалось. Таким образом, в ходе вышеописанных
реакций тиофеновое кольцо сохраняется неизменным, в отличие от аналогичных
производных фурана. Это неудивительно, поскольку энергия ароматической
стабилизации тиофенового кольца гораздо больше, чем фуранового. Этим же
объясняется и низкий выход в случае самого тиофена. Следует заметить, что
впервые полученные нами азиридины (13-16) относятся к неописанному ранее классу
азиридинилтиофенов.
Следует отметить, что в спектрах ПМР
главных инвертомеров соединений (13-15) разность химических сдвигов
азиридиновых протонов достаточно велика и составляет примерно 1 м.д., тогда как
у минорных инвертомеров она мала и мы наблюдали в спектрах АВ-системы.
Поскольку эффективный объем тиофенового кольца явно больше, чем групп COCH3, СOOC2H5, и CON(C2H5)2, то основным инвертомером должен
являться анти-инвертомер по отношению к тиофеновому циклу. Известно, что
фталоильная группа дезэкранирует син-расположенные к ней протоны азиридинового
кольца, поэтому можно утвеждать, что в более слабых полях находятся именно
протоны, расположенные рядом с тиофеновым циклом. В согласии с этим, в спектре
ПМР соединения (16), в котором присутствует значительно больший по
объему бензоильный фрагмент, соотношение химических сдвигов протонов главного и
минорного инвертомера меняется на противоположное – разница хим. сдвигов больше
для минорного инвертомера. Очевидно, в данном случае основным является
син-инвертомер по отношению к тиофеновому фрагменту.
Экспериментальная
часть
Элементные анализы
соединений выполнены на С, Н, N-анализаторе НР-185В фирмы Hewlett—Packard.
Спектры ЯМР 1Н (300 МГц) и 13С (75.4 МГц) получены на
спектрометре DPX-300 фирмы Bruker для растворов в CDCI3, с
использованием в качестве внутреннего стандарта для ПМР — сигнала остаточного
хлороформа (d=7.26 м.д.), для 13С
— сигнала растворителя (d=77.16 м.д.). Масс-спектры сняты на приборе МХ-1321 (энергия
ионизирующих электронов 70 эВ). Состав и чистоту полученных препаратов
контролировали с помощью ТСХ на пластинах Silufol UV-254.
Синтез исходных и вспомогательных соединений был
проведен при помощи известных методик [5-17].
Фталимидоазиридинирование предельных производных
тиофена
Общая методика
окислительного фталимидоазиридинирования:
К
раствору 3 ммоль соответствующих предельных производных тиофена (1-5) в 30 мл хлористого метилена прибавляют 1,24 г (9
ммоль) тонкорастертого поташа, охлаждают жидким азотом в бане с этилацетатом до
–200С и при перемешивании магнитной мешалкой поочередно прибавляют в
течение 15 минут небольшими порциями тетраацетат свинца (3 ммоль, 1,33 г) и
N-аминофталимид (3 ммоль, 0.48г). Затем перемешивают при охлаждении еще 30 мин,
фильтруют через силикагель и промывают осадок хлористым метиленом до
обесцвечивания фильтрата. Фильтрат упаривают, остаток промывают гексаном для
удаления исходного соединения, сушат в вакууме и производят съемку спектра ПМР
реакционной смеси. В случае тиофен-2-карбальдегида (2), этилового эфира (4) и
диэтиламида (5)
тиофен-2-карбоновой кислоты в спектрах наблюдались лишь сигналы фталимида в
области 7.7-7.9 м.д. (масса 0,26-0,33 г, выход фталимида составлял 60-75%) В
области азиридиновых протонов (3.5-5.0 м.д.) сигналы отсутствовали. В случае
незамещенного тиофена (1) в
области 4.05-4.15 м.д. наблюдалась АВ-система (точнее АА,ВВ,)
с константой спин-спинового взаимодействия 5.5 Гц. Кроме того, наблюдался
интенсивный мультиплет фталоильных протонов. Исходя из интегральной
интенсивности сигналов, в спектре ПМР доля бис-азиридина (6) в смеси с фталимидом составляла 20% (масса
реакционной смеси 0,35 г, расчетный выход (6)-16%). При проведении колоночной хроматографии на
силикагеле (элюент – хлористый метилен) имело место осмоление, и индивидуальный
азиридин выделить не удалось. Перекристаллизация из спирта также приводят к
осмолению, а попытки отделить аддукт от фталимида извлечением эфиром или
четыреххлористым углеродом также не увенчались успехом. В случае 2-метилтиофена
(3) сильное осмоление наблюдалось еще в ходе проведения
реакции фталимидоазиридинирования. Спектр ПМР реакционной смеси был нетрактуем,
а выделить индивидуальные продукты с помощью колоночной хроматографии на
силикагеле (элюент – хлористый метилен) не удалось.
Фталимидоазиридинирование непредельных производных
тиофена
Общая методика окислительного
фталимидоазиридинирования:
К
раствору 3 ммоль соответствующих непредельных производных тиофена в 30 мл
хлористого метилена прибавляют 1,24 г (9 ммоль) тонкорастертого поташа,
охлаждают жидким азотом в бане с этилацетатом до -200С и при
перемешивании магнитной мешалкой поочередно прибавляют в течение 15 минут
небольшими порциями тонко растертые N-аминофталимид (3 ммоль, 0.48г) и
тетраацетат свинца (3 ммоль, 1,33 г). Затем перемешивают при охлаждении еще 30
мин, фильтруют через силикагель и промывают осадок хлористым метиленом до
обесцвечивания фильтрата. Фильтрат упаривают и добавляют небольшое количество
эфира. Если при этом остаток кристаллизуется (в случае этилового эфира (7) и диэтиламида (8) 3-(2-тиенил)акриловой кислоты, тиенальацетона (9) и тиенальацетофенона (11) ), выпавшие кристаллы фильтруют и промывают эфиром. Затем
перекристаллизовывают продукт из спирта. В случае аддукта с тиенальацетоном при
попытках перекристаллизации происходит сильное осмоление, и для его очистки
использовалось переосаждение гексаном из растворов в четыреххлористом углероде.
В случае дитиенальацетона (10) и
2-(2-нитровинил)тиофена (12) сильное
осмоление наблюдалось еще в реакционной смеси, а при добавлении эфира
кристаллизации не происходило. Спектры ПМР реакционных смесей были
нетрактуемыми. При хроматографировании реакционных смесей на силикагеле (элюент
–хлористый метилен) индивидуальных продуктов выделить не удалось. В случае
исходных соединений (7,8,9,11) были получены фталимидоазиридины (13-16).
Выход (13) –714 мг (70%), Т.пл. = 174-1750С. Брутто-формула С17Н14N2O4S. Рассчитано, %: С 59,65; Н 4,09; N 8,19. Найдено, %: С 59,70; Н 4,35; N 8,04. Выход (14) – 606 мг (55%), Т.пл. =
124-1250С. Брутто-формула С19Н19N3O3S. Рассчитано, %: С 61,79; Н 5,15; N 11,38. Найдено, %: С 61,73; Н 5,31; N 11,22. Выход (15) – 558 мг (61%), Т.пл. =
154-1550С. Брутто-формула С16Н12N2O3S. Рассчитано, %: С 61,54; Н 3,85; N 8,97. Найдено, %: С 60,52; Н 3,94; N 9,66. Масс-спектр, м/z (I, %): 312 (М.+,
10), 270 (100), 269 (29), 165 (34), 124 (24), 123 (43), 122 (58), 104 (60), 97
(29), 96 (43), 76 (68), 50 (26), 43 (65). Выход (16) – 840 мг (75%),
Т.пл. = 137-1380С. Брутто-формула С21Н14О3N2S. Рассчитано,
%: С 67,40; Н 3,74; N 7,49. Найдено, %: С 67,46; Н
3,86; N 7,54.
Список литературы
[1] Иоффе Б.В., Кузнецов М.А. // Успехи химии, 1972,
Т.72, вып.2, С. 241-271.
[2] Иоффе Б.В., Кузнецов М.А. // Успехи химии, 1985,
Т. 59, вып. 8, С. 1271-1297.
[3] Игнатенко О.А., Бландов А.Н., Кузнецов М.А. //
Журн. Орг. Химии, 2005, Т. 41, вып. 12, С. 1830-1837.
[4] Игнатенко О.А. // Дисс….канд. хим. наук, СПб,
2007.
[5] Физер Л., Физер М. // Реагенты для органического
синтеза, М: Мир, 1970, Т.3, C. 208-209.
[6] Drew H. D.,
Hatt H.H. // J.Chem.Soc., 1937, (1), P.16-26.
[7] Агрономов А.Е., Шабаров Ю.С. // Лабораторные
работы в органическом практикуме, изд. МГУ, 1971, С 104-105.
[8] Reichstein T.
// Helv.Chim.Acta, 1930, 13, P. 349-356.
[9] Jones L.W.,
Hurd C.D. // J.Am.Chem.Soc., 1921, 43, P. 2422-2448.
[10] Nahnsen R. //
Chem.Ber., 1884, 17, S. 2192-2196.
[11] Jones E.,
Moodie I.M. // J.Chem.Soc.(C), 1968, (10), P. 1195-1196.
[12] King W.J.,
Nord F.F. // J.Org.Chem., 1949, 14 (3), P. 405-410.
[13] Корнилов М.Ю., Рубан Е.М., Федчук В.Н.,
Старинская Е.В., Бузник М.В. // ЖОрХ, 1973, 9(12), С. 2577-2582.
[14] Keskin H.,
Miller R.E., Nord F.F. // J.Org.Chem., 1951, 16 (2), P. 100-206
[15] Bolourtchian
M., Sayednya A. // Compt.Rend., 1976, 283(12), P.545-548.
[16] Гришкевич-Трохимовский Е, Мацуревич Н. // ЖРФХО,
1912, 44, С. 570-581.
[17] Miller R.E.,
Nord F.F. // J.Org.Chem., 1951, 16 (11), P.1720-1730.