Химия и химические технологии/ 6.Органическая химия
Косицына
А.С., Роот Е.В., Субоч Г.А.
Сибирский государственный технологический университет, Россия
Синтез N,3,5-замещенных п-фенилендиаминов
Существующие методы синтеза замещенных п-фенилендиаминов имеют ограничения,
связанные с условиями получения, низкими выходами и трудностью введения
заместителей. В тоже время, применение п-фенилендиаминов
в качестве антиоксидантов пластмасс и эластомеров, а также промежуточных
продуктов в синтезе красителей и различных органических веществ, в том числе
обладающих биологической активностью, делает актуальным поиск новых методов их
синтеза.
Чаще всего, замещенные п-фенилендиамины получают
восстановлением 4-нитроанилинов соответствующего строения. Более удобными
исходными, на наш взгляд, являются 4-нитрозоанилины, поскольку они гидрируются
легче, по сравнению с нитросоединениями, и в ряде случаев реакция образования
4-нитрозоанилинов протекает более селективно.
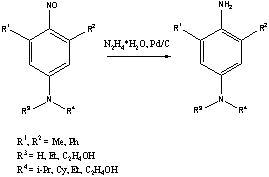
N,3,5-Замещенные п-фенилендиамины
были получены из 3,5-замещенных 4-нитрозоанилинов восстановлены гидразингидратом
в спирте в присутствии Pd/C. В результате были выделены ранее неизвестные п-фенилендиамины с заданными
заместителями в ароматическом ядре и у атома азота.
Строение N,3,5 – замещенных п-фенилендиаминов
подтверждено данными ЯМР-спектроскопии. В ЯМР 1Н спектрах
присутствуют сигналы алкильных фрагментов у атома азота, сигналы заместителей
кольца, а также сигналы ароматических протонов. Кроме того, имеются сигналы
протонов аминогрупп.
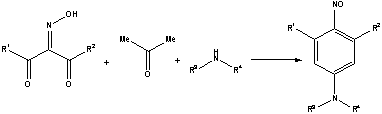
N,3,5-замещенные 4-нитрозоанилины получали трехкомпонентной
конденсацией 1,3-дикетонов с аминами и ацетоном [1].
Для расширения полезной области применения
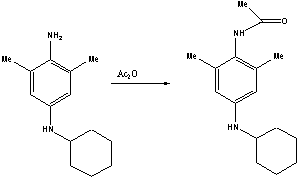
были изучены химические свойства впервые выделенных п-фенилендиаминов на примере N-циклогексил-3,5-диметил-1,4-фенилендиамина.
Ацилирование уксусным ангидридом на холоду позволило получить ацетамидное
производное, строение которого также подтверждено методом ЯМР-спектроскопии.
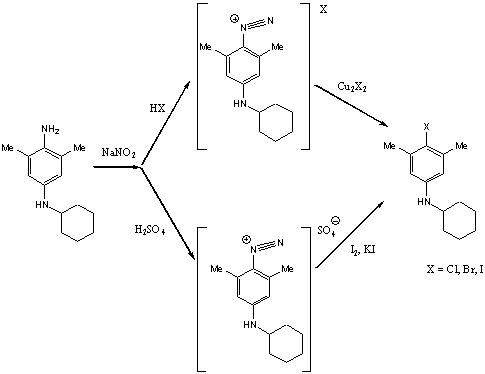
Наличие первичной аминогруппы в
ароматическом кольце открывает возможность перехода к различным классам
органических соединений. Диазотирование замещенных п-фенидендиаминов и последующая замена диазогруппы позволили синтезировать
ранее недоступные производные 4-галогенанилинов. В ЯМР 1Н спектрах 4-галогенпроизводных
присутствуют сигналы циклогексильного фрагмента, метильных групп и сигналы ароматических
протонов. Причем сигнал протонов первичной аминогруппы отсутствует.
Таким образом, предложен удобный метод
синтеза замещенных п-фенилендиаминов,
который предполагает восстановление замещенных 4-нитрозоанилинов. Для ранее
неизвестных п-фенилендиаминов изучены
химические свойства и показана возможность реакций ацилирования,
диазотирования, замены диазогруппы на галоген.
Работа выполнена при финансовой поддержке гранта молодых ученых ККФНП и НТД 2011 г.
Литература:
1. Беляев Е.Ю., Субоч Г.А., Ельцов
А.В. // ЖОрХ. 1978. Т. 14, вып. 7. С.1506-1511