К.х.н. Берлинский И.В.,
проф. Чиркст Д.Э., доц. Лобачева О.Л.
Санкт-Петербургский
государственный горный университет, Россиия.
Ионная флотация гидроксокатионов
иттербия.
Редкоземельные
элементы (РЗЭ) обладают уникальными свойствами, благодаря чему используются в различных сферах современной
промышленности, особенно в наукоемких технологиях. Уровень их применения в различных областях
является показателем научно-технического развития тех или иных отраслей,
способствует экономии минерального сырья, улучшению экологической обстановки,
обеспечению национальной безопасности. Мировой спрос на редкоземельную
продукцию в последние 20 лет развивается по возрастающему тренду. Экспорт РЗЭ в
составе высокотехнологичных продуктов и изделий наиболее выгоден, и именно он обеспечивает
развитым государствам максимальную прибыль [1].
В
процессе ионной флотации катионов металлов по данным, имеющимся в литературе [2],
степень извлечения резко возрастает в области pH гидратообразования.
Предполагается, что ионная флотация цветных металлов протекает с образованием
их основных солей с анионными поверхностно-активными веществами (ПАВ) [3]. Для
установления механизма процессов и прогнозирования оптимальных условий
извлечения и разделения катионов металлов методами экстракции и ионной флотации
необходимо знать рН образования гидроксокомплексов металлов и рН
гидратообразования, которые могут быть рассчитаны на основе энергий Гиббса
образования гидроксокомплексов и гидроксидов металлов.
Измерения
удельной электропроводности проводили с помощью кондуктометра марки «Анион
4100». Стандартный раствор нитрата иттербия с концентрацией 0,001 моль·кг-1
готовили из оксида иттербия марки «х.ч.». С помощью иономера «Анион 7010»
параллельно измеряли pH раствора. По результатам строили кривую титрования,
представленную на рисунке 1. Результаты титрования с целью подтверждения их
достоверности были дважды воспроизведены.
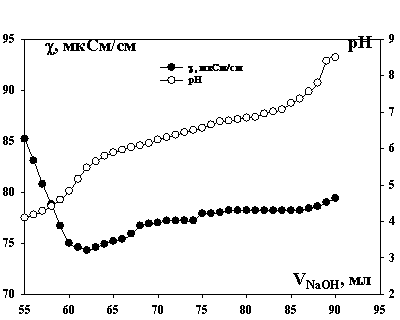
Рис.
1. Зависимость удельной электропроводности раствора Yb(NO3)3 и рН от
объема раствора NaOH в ходе
кондуктометрического и потенциометрического титрования.
На кривых
кондуктометрического титрования выделяются следующие участки. Линейное
понижение удельной электропроводности вследствие нейтрализ ации азотной кислоты
щелочью. На зависимости удельной электропроводности от объема добавленной
щелочи наблюдается резкий излом с переходом к почти горизонтальному участку,
что свидетельствует о связывании добавляемых анионов гидроксила в
малодиссоциированное соединение. Так как образования гидроксидов не наблюдали
(оптическая плотность растворов не изменялась), этот участок отвечает
образованию гидроксокомплексов. По количеству миллиэквивалентов щелочи и
изломов на кривых титрования определили образование моногидроксокомплексов Yb(OH)2+,
дигидроксокомплексов Yb(OH)2+
и гидроксидов Yb(OH)3. Далее на кривых титрования
наблюдается почти линейный рост удельной электропроводности, обусловленный
избытком щелочи.
Ионную
флотацию иттербия (3+) изучали из водного раствора нитрата с концентрацией
0,001 моль·кг−1 с помощью додецилсульфата натрия (NaDS),
концентрация которого соответствует стехиометрии реакции:
![]()
Флотация
проводилась на лабораторной установке механического типа 137 В-ФЛ, с объемом
камеры 1,0 дм3.
В
водной фазе после флотации определяли концентрацию катионов иттербия
фотометрическим методом с арсеназо III [4] и DS- (С12H25OSO3-) путем
потенциометрического титрования 0,002 моль·дм−3 раствором
хлорида цетилтриметиламмония с ионоселективным электродом [5,6].
Экспериментальные
данные зависимости коэффициента распределения: 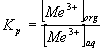 ионов иттербия из
нитратных сред от рН раствора представлены на рисунке 2.
ионов иттербия из
нитратных сред от рН раствора представлены на рисунке 2.
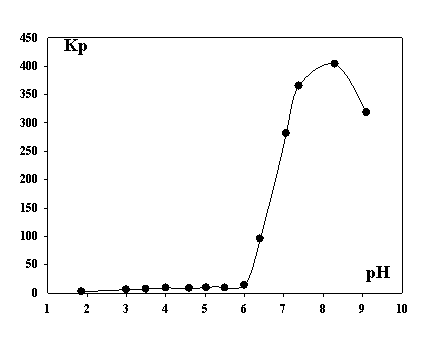
Рис.
2. Зависимость коэффициента распределения Кр ионов Yb3+ от рН раствора.
Значение
рН, при котором начинается резкое увеличение коэффициента распределения, равно
6,2 и соответствует данным кондуктометрического титрования рН образования
дигидроксокомплекса иттербия 6,30±0,14 (при равенстве концентраций [Yb(OH)2+]
= [Yb(OH)2+]). На этом основании
можно предположить, что иттербий флотируется преимущественно в форме основного
додецилсульфата дигидроксоиттербия Yb(OH)2(C12H25OSO3). При этом достигается
коэффициент распределения более 400. Максимальное
извлечение происходит в области рН образования гидроксидов, но в ходе
эксперимента выпадение осадков не наблюдали, что можно объяснить образованием в
водной фазе устойчивых комплексов гидроксокатионов с додецилсульфатом.
Литература:
1.
В.В.
Комольцев, Ф.Д. Ларичкин, А.А. Александров Конъюнктура рынка редкоземельных
металлов. / Цветная металлургия. 2004. №11. С.8-12.
2.
Grieves R.B., Charewicz W.R. Ion and
colloid flotation of Ni, Co and Pt // Separation Science. 1975. Vol.10. N 1. P.77-92.
3.
Gassett B.B., Otis J.S., Peter F.A.
The Influence of various parameters on foam separation / J.Water Pollution
Control Fed. 1965. V. 37. N 4. p. 460.
4.
С.Б. Савин Арсеназо III. / М.: Атомиздат. 1966.
265 с.
5.
С.В.Тимофеев,
В.А.Матерова, Л.К Архангельский. Электродное
поведение анионселективных мембран / Вестник ЛГУ. Серия физика, химия. 1978. №
16. Вып. 3. С. 139-141.
6.
Д.Э.
Чиркст, О.Л. Лобачева, И.В.Берлинский Извлечение и разделение ионов Се3+
и Y3+ методом ионной флотации. / Ж. Прикл. Хим. 2009. Т. 82. № 8.
С. 1273 - 1276.