Изменение
кровоснабжения в гиперплазии предстательной железы под действием аналогов ЛГРГ.
В.О. Бушуев,
В.А. Варшавский, Л.М. Рапопорт, Ю.Г. Аляев
(Клиника
Урологии ММА им.И.М. Сеченова дир. член
корр. РАМН проф. Ю.Г. Аляев)
Данные аутопсий
свидетельствуют, что ДГПЖ может развиваться даже до 30 лет, причем усиленный
рост приходится на 40 лет [5].
Предстательная железа является
гормонозависимым органом. В ходе развития её эпителий и мезенхима находятся под
контролем андрогенов [6]. В 1895 г. J. White и соавт. сообщили о результатах лечения больных с
доброкачественной гиперплазией предстательной железы (ДГПЖ) путем двусторонней
орхиэктомии [12], а в 1986 г. В. Otnes доказал: ДГПЖ может регрессировать после
проведения терапии антиандрогенами [11], что было подтверждено многими учеными.
Однако, исследований, направленных на изучение кровоснабжения предстательной
железы (ПЖ) в условиях гипотестостеронемии нет.
Нами проанализированы данные, касающиеся 20
пациентов с ДГПЖ размером от 80 до 260 см3 получавшие в качестве
предоперационной подготовки аналог ЛГРГ (лютеинизирующего
гонадотропин-рилизинг-гормона) в течение 6 месяцев. Им проводилась биопсия
простаты до и после лечения. Средний возраст обследованных составил 71,6 ±4,0
года, средний уровень простатоспецифического антигена (ПСАобщ) в
сыворотке крови – 12,94±6,4 нг/мл, средний объем железы до приема препарата –
135,53±45,08 см3, после приема – 102,1±20,2 см3
Прежде чем изучить влияние аналогов ЛГРГ
на кровоснабжение ПЖ, мы исключили из исследования пациентов с редко
встречающиеся формами гиперплазии: постатрофической, папиллярной, криброзной,
базально-клеточной и раком ПЖ. С целью исключения последнего всем пациентам с
повышенным ПСА (> 4 нг/мл) выполнялась пункционная биопсия ПЖ под
УЗ-контролем.
В 1987 г. C. Peters и P. Walsh сообщили о
9 пациентах с ДГПЖ, которым выполняли инъекции аналога LHRH нафарелина ацетата (400 пг в день подкожно) в течение
4 мес. У всех 9 больных объем ПЖ уменьшился после 4 мес терапии на 24,2%.
Данные морфометрического анализа образцов биопсии до и после завершения лечения
продемонстрировали регресс эпителия на 40% и сокращение стромы – на 21%. По
нашим данным, под действием терапии аналогами LHRH происходит уменьшение размеров ДГПЖ на 29,46%.
Считаем, что это обусловлено крайне низкой встречаемостью собственно железистой
формы гиперплазии и высокой – смешанной, железисто-фиброзной формы у мужчин со
значительным увеличением железы. Нами железисто-фиброзная форма гиперплазии
выявлена у 49,25%, мышечно-фиброзная – у 23,88%, железисто-фиброзно-мышечная –
у 14,92%, постатрофическая – у 7,46%, собственно железистая – у 4,47% больных.
У больных, страдающих ДГПЖ больших
размеров, встречаемость простатической интраэпителиальной неоплазии низкой
степени выявлена у 32,83%, высокой – у 52,23%; у 14,94% пациентов
неопластический процесс в эпителиальных клетках отсутствовал вовсе.
В.В.Ловцов (1999)
после анализа большого объема литературы [8-10], а также результатов
собственных исследований определил, что ПЖ имеет богатое кровоснабжение из многочисленных источников.
Основными являются нижние пузырные, средние пузырные, средние прямокишечные и
срамные артерии. К дополнительным
источникам кровоснабжения (через анастомозы) относятся запирательные, нижние ягодичные и
артерии семявыносящих
протоков [3]. По данным Е. Cleg (1956) [7], артериальные сосуды капсулярной
группы в верхнебоковых, передних и апикальных отделах органа отдают в толщу ПЖ
межжелезистые артерии, которые идут радиально и центростремительно в
мышечно-соединительнотканных прослойках, анастомозируя между собой и затем – с
идущими вдоль мочеиспускательного канала уретральными сосудами. При развитии в ПЖ узлов
гиперплазии последняя своим ростом резко изменяет анатомическое строение
мочеполового венозного
сплетения, которое увеличивается в размерах и уже не имеет извитого, гроздевидного характера,
оставляя диаметр стволов прежним. Гиперплазированная ПЖ оказывается окруженной венозными стволами
различного калибра практически
со всех сторон. Повреждение этих вен может вызвать значительную геморрагию,
сказаться на исходе вмешательства, а в послеоперационном периоде вызвать нежелательные
осложнения [3].
Таким
образом, при развитии гиперпластических процессов в ПЖ увеличивается количество
сосудов как артериального, так и венозного звена, что особенно актуально у
пациентов с большими размерами аденомы. В настоящее время ведутся исследования,
направленные на улучшение предоперационной подготовки пациентов с ДГПЖ для
уменьшения одного из грозных осложнений операции на ПЖ – кровотечения. Многие исследователи признают тот факт, что ингибиторы
5-α-редуктазы замедляют рост и уменьшают плотность сосудов
микроциркуляторного русла [2]. Однако длительный прием до получения
результатов (0,5 года), незначительное сокращение объемов (~15%) делают
недостаточно эффективной предоперационную подготовку препаратами данной группы
у больных со значительной ДГПЖ. Основной задачей нашего исследования явилось
определение влияния терапии аналогами LHRH на сосуды
микроциркуляторного русла при ДГПЖ больших размеров.
Проведенное нами исследование показывает, что
количество сосудов и толщина их стенки уменьшаются после 3–6 мес терапии
аналогами LHRH. Среднее
количество артериол на 1 см² сократилось на 0,13 сосуда (p=0,032),
венул – на 0,92 сосуда[1]
(p=0,001). При этом толщина стенки артериол уменьшилась на 13,83 мкм (p<0,05;
рис 1, 2), а толщина стенки венул – на 10,08 мкм (p<0,05). Интересно, что диаметр сосудов разного вида
по-разному реагирует на данную терапию: в сосудах артериального типа он
уменьшился на 84,99 мкм (р<0,05), а венозного – увеличился на 13,35 мкм (p=0,013). Учитывая, что количество венул сокращается на
фоне проводимой терапии, мы предполагаем, что диаметр их вырос вследствие
облитерации мелких сосудов.
В нашем исследовании склероз стенки
сосудов после проведенной терапии выявлен в 90% случаев. В гистологическом
материале, полученном
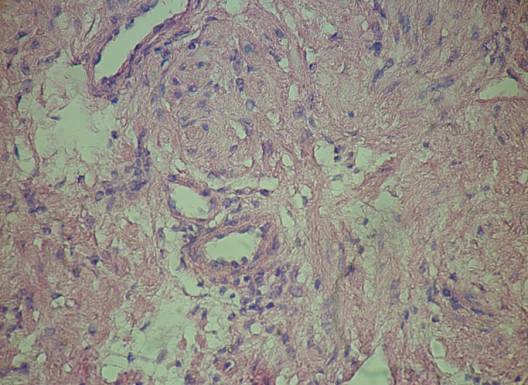
Рис. 1. Толщина
стенки сосудов (стрелки) до проведения терапии аналогами LHRH Окраска гематоксилином и эозином. ×400
![]()
![]()
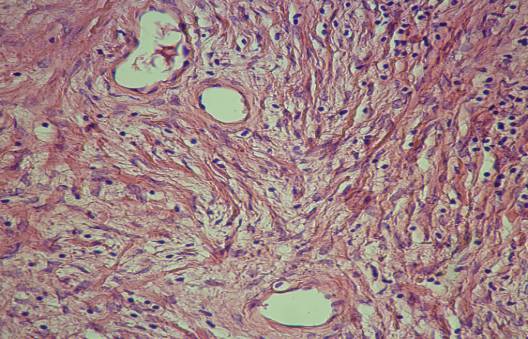
Рис. 2. Склероз
стенки (указано стрелкой), развившийся после терапии аналогами LHRH


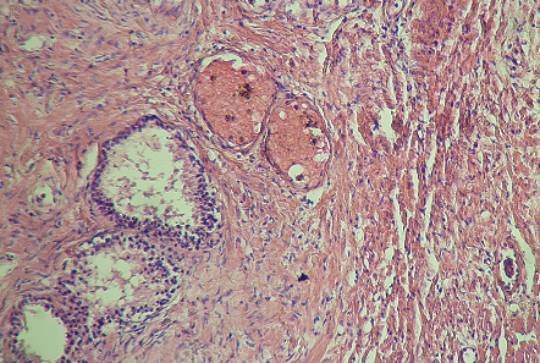
после трансуретральной резекции ДГПЖ в случае
подготовки к операции аналогом LHRH нередко
встречается тромбоз сосудов (рис. 3). Мы не утверждаем, что на фоне такой
подготовки развивается тромбоз сосудов, но считаем необходимым дальнейшее
тщательное изучение.
По данным разных авторов [1], ДГПЖ в
65–80% случаев сопровождается воспалительным процессом. Полученные нами данные
о наличии у больных с ДГПЖ больших размеров значительной лимфогистиоцитарной
инфильтрацией достоверно не отличались от таковых при гиперплазии меньших
размеров (79,31%).

Воспалительный процесс в ПЖ играет
немаловажную роль в развитии ранних и поздних послеоперационных осложнений [4].
Анализ продемонстрировал низкую выявляемость воспалительного процесса при
исследовании секрета ПЖ (или III порции мочи)
по сравнению с частотой, подтвержденной гистологическими исследованиями (в
расчет вошли пациенты, у которых при гистологическом исследовании выявлена
значительная лимфогистиоцитарная инфильтрация).
Проведенные исследования показывают, что
терапия аналогами LHRH при ДГПЖ больших размеров
позволила в среднем на 25% сократить количество сосудов как венозного, так и
артериального типа в единице объема железы и в среднем на 38,6% уменьшить
диаметр сосудов артериального типа. Под действием аналогов
горадотропин-рилизинг-гормона в 90% случаев уменьшается толщина стенки сосудов,
а также развивается склероз последней.
Литература
1.
Аляев Ю.Г., Винаров
А.З., Локшин К.Л. и соавт. Трансректальная цветная допплерография у больных с
заболеваниями предстательной железы. – М., 2004. – С. 81.
2.
Голощапов Е. Т., Лукичёв
Г.Б., Крюкова Н.Ю. Современные решения и технологии в урологии изменение
кровотока в простате у больных с ДГПЖ под влиянием ингибиторов
5-α-редуктазы. Материалы 4-й
международной конференции «Малоинвазивные методы диагностики и лечения в
современной урологии». – СПб., 26–27 апреля 2007.
3.
Ловцов В. В.
Морфопатогенетические аспекты в выборе метода оперативного лечения больных
доброкачественной гиперплазией простаты. Дис… докт. мед. наук. – Саратов, 1999.
– С. 143
4.
Мартов А.Г., Камалов
А.А. Малоинвазивные эндоскопические методы лечения доброкачественной
гиперплазии предстательной железы в Кн.: Доброкачественная гиперплазия
предстательной железы / Под ред. Н.А Лопаткина. – М., 1999. – С. 210.
5.
Петров С.Б., Левковский
Н.С. Современные методы диагностики и лечения больных с доброкачественной
гиперплазией предстательной железы // СПб.: 1998. - С. - 14-17.
6.
Хэм А., Д. Кормак
Гистология том 5 Москва «Мир» 1983. с. 214
7. Clegg
E. The vascular arrangements within the human prostate gland // Br. J. Urol. –
1956; 28: 428–435.
8.
Corning H.K. Руководство по топографической анатомии. – Берлин,
1907. – Издательство «Врачъ».
9. Epstein J.
Non-neoplastic diseases of the prostate. In: Bostwick DG EJUSP, 1st Edition,
ed. St louis, USA. Mosby-Year Book Inc: 1997, 307–340.
10.
Flocks R.: Arterial distribution within prostate
gland: Its role in transurethral prostatic resection // J. Urol. – 1937; 37:
524–548.
11.
Otnes B. Ramm-Whites operasjon: kastrasjon for prostata-hyperplasi //
Tidsskr Nor Laegeforen. – 1986; 106: 301–303.
12.
White J. The results of double castration in hypertrophy of the prostate
// Ann. Surg. – 1895; 22: 1–80.