Физика/8. Молекулярная физика
К.ф.-м.н. Павлов В.А.
Санкт-Петербургский национальный исследовательский университет информационных
технологий, механики и оптики, Россия
Термодинамическая
теория плавления наночастиц
Точные уравнения термодинамики малых систем имеют вид [1]:
![]() , (1)
, (1)
![]() (2)
(2)
(используются,
в основном, стандартные обозначения – см. [2]). При ![]()
![]() . (3)
. (3)
Нанотермодинамика – это учёт следствий ненулевой
величины ![]() .
.
В нанотермодинамике
[1], в отличие от обычной термодинамики макроскопических систем, возникают два химических потенциала: «интегральный» ![]() и «дифференциальный»
и «дифференциальный» ![]() , для которых
, для которых
![]() , (4)
, (4)
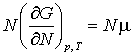 , (5)
, (5)
где ![]() – свободная энергия
Гиббса , N – число молекул в
наночастице. Различие между потенциалами
– свободная энергия
Гиббса , N – число молекул в
наночастице. Различие между потенциалами ![]() и
и ![]() связано с ненулевым
значением
связано с ненулевым
значением ![]() :
:
![]() . (6)
. (6)
Когда
число молекул ![]() , химические потенциалы
, химические потенциалы ![]() и
и ![]() стремятся к одному пределу
стремятся к одному пределу ![]() . В статье [3] показано, что химические
потенциалы при фиксированной массе частицы удовлетворяют следующим уравнениям:
. В статье [3] показано, что химические
потенциалы при фиксированной массе частицы удовлетворяют следующим уравнениям:
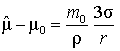 , (7)
, (7)
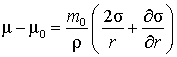 , (8)
, (8)
где ![]() – масса молекулы,
– масса молекулы, ![]() – плотность
наночастицы,
– плотность
наночастицы, ![]() –
поверхностное натяжение, r
– радиус эквимолекулярной поверхности
(её определение дано на с. 15 в книге [4]).
–
поверхностное натяжение, r
– радиус эквимолекулярной поверхности
(её определение дано на с. 15 в книге [4]).
Формулы (7)-(8) можно использовать как в
жидком, так и в твёрдом состояниях; при этом следует брать ![]() , описывающий
соответствующую макроскопическую фазу. Для наночастиц, которые способны
затвердеть или, наоборот, расплавиться, имеются четыре химических потенциала:
два «дифференциальных» химических потенциала
, описывающий
соответствующую макроскопическую фазу. Для наночастиц, которые способны
затвердеть или, наоборот, расплавиться, имеются четыре химических потенциала:
два «дифференциальных» химических потенциала ![]() и два «интегральных»
и два «интегральных» ![]() . Далее индексы
. Далее индексы ![]() и
и![]() соответствуют твёрдому состоянию и жидкому.
соответствуют твёрдому состоянию и жидкому.
В разделе 5-4 книги
Хилла [1] показано: фазовый переход происходит при совпадении «интегральных»
химических потенциалов
![]() .
(9)
.
(9)
Согласно
Хиллу температура плавления наночастицы (см. (5-151) в [1])
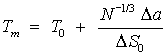 , (10)
, (10)
где ![]() – температура плавления наночастицы,
– температура плавления наночастицы, ![]() – температура
плавления макроскопического (большого) кристалла,
– температура
плавления макроскопического (большого) кристалла, ![]() – изменение удельной энтропии при плавлении кристалла (на
одну молекулу), N – число молекул в наночастице,
– изменение удельной энтропии при плавлении кристалла (на
одну молекулу), N – число молекул в наночастице,
![]() , (11)
, (11)
![]() и
и ![]() –
поверхностное натяжение жидкой и твёрдой частиц одинаковой массы, А
– площадь поверхности частицы. При этом
величина
–
поверхностное натяжение жидкой и твёрдой частиц одинаковой массы, А
– площадь поверхности частицы. При этом
величина ![]() .
.
Получена формула для
температуры плавления наночастицы [3]:
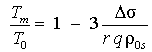 ,
(12)
,
(12)
где ![]() – эквимолекулярный
радиус твёрдой частицы, q – удельная
теплота плавления. Величина
– эквимолекулярный
радиус твёрдой частицы, q – удельная
теплота плавления. Величина ![]() ,
,
![]() , (13)
, (13)
![]() и
и ![]() – плотности
макроскопических фаз, кристалла и жидкости.
– плотности
макроскопических фаз, кристалла и жидкости.
Понижение температуры
плавления при уменьшении размера частицы, было обнаружено экспериментально сто
лет тому назад [5]. Сначала были взяты частицы микронного размера, поэтому
эффект был невелик – порядка градуса. С появлением электронных микроскопов
начали наблюдать понижение температуры плавления в десятки градусов. В 70-е
годы уже наблюдались эффекты в сотни градусов, для чего частицы металлов должны
быть меньше десяти нанометров [6, 7].
В настоящем сообщении
предлагаются формулы, связывающие диаметр наночастицы ![]() и температуру её
плавления:
и температуру её
плавления:
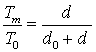 , (14)
, (14)
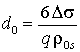 . (15)
. (15)
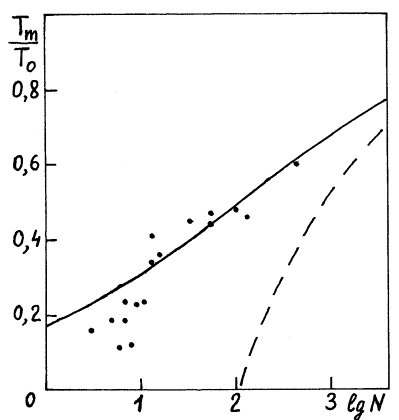
Рис. 1 Температура плавления наночастиц
аргона ![]() от числа молекул N.
от числа молекул N.
На рисунке показана зависимость
температуры плавления от числа молекул в наночастице на примере аргона (точки – данные численного эксперимента). Сплошная линия
получена по формулам (14)-(15).
Пунктир соответствует формуле (12) при постоянной величине (13).
Видно, что предложенные
формулы (14)-(15) удовлетворительно описывают плавление наночастиц аргона при
числе молекул N>12.
В публикации [7]
использована формула, аналогичная (12), но отличающаяся тем, что коэффициент 3
в правой части (12) заменён коэффициентом 2. Эта замена эквивалентна
предположению, что ![]() . Это противоречит основным положениям нанотермодинамики,
изложенным в книге [1].
. Это противоречит основным положениям нанотермодинамики,
изложенным в книге [1].
Настоящая работа
использует положения нанотермодинамики, а также приближённые формулы (14)-(15).
Для улучшения совпадения с экспериментальными данными необходимо
уточнить формулу (14) при малых N.
Литература:
[1] Hill T.L.Thermodynamics of Small Systems.
Benjamin,
New York,
1963.
[2] Ландау Л.Д., Лифшиц Е.М. Статистическая
физика. Часть 1. Наука, М., 1976. С. 12.
[3] Павлов В.А. Использование термодинамики
малых систем в теории плавления наночастиц // Вестник Санкт-Петербургского
университета. Сер. 4 (Физика, химия). Вып. 3 (2007) 70.
[4] Оно С., Кондо С. Молекулярная теория
поверхностного натяжения в жидкостях. ИЛ, М., 1963.
[5] Pawlow P. Uber
die Abhangigkeit des Schmelzpunktes von der Oberflachen- energie eines festen
Korpers // Z. phys. Chem. 65 (1909) 1.
[6] Павлов В.А. Отличия нанотермодинамики от
классической термодинамики // Вестник Санкт-Петербургского университета. Сер. 4
(Физика, химия). Вып. 1 (2010) 24.