Идентификация
особей наземной и водной экобиоморфы V.
anagallis-aquatica L.
из секции Beccabunga с помощью анализа генов 18S
рРНК и matK.
©
А. А. Мислицкая1, В.В. Мислицкий3, Д. В. Новиков2,
В. В. Новиков1,2
1 «Вятский
государственный гуманитарный университет»( г. Киров)
2«Нижегородский государственный университет им. Н. И.
Лобачевского»( г. Нижний Новгород)
3 МАОУ "Средняя общеобразовательная школа №2 с
углубленным изучением иностранных языков" (г. Ноябрьск, ЯНАО)
Проблема систематики растений с использованием
новейших молекулярно-генетических методов в современном обществе является
актуальной. Мы идем к тому, что все группы эукариот будут систематизированы по
генетическим признакам. ДНК - шрихкодирование – метод молекулярной
идентификации растений. Из-за и
сетчатой эволюции для разрешения отношений видов растений в большей мере, чем
при изучении высших таксонов, необходимо использование множественных
независимых маркеров, ядерных и органельных. Отсутствие конгруэнтности
соответствующих топологий - свидетельство гибридизации. Работа, относительно
проблемы генетической систематики растений, включает несколько направлений – от
сбора растений и описания новых таксонов до генетических экспериментов.
Известно, что для многих видов Veronica L. свойственна поливариантность развития.
Особенно это характерно для V. anagallis-aquatica L. из секции Beccabunga. На основании
морфологической поливариантности особей в наземных популяциях этого растения
выделены несколько самостоятельных видов: V. poljensis,
V. heureka, V.
anagallis-aquatica subsp.
аnagalloides, V. anagalloides, V. tenuis.
Они отличаются по ряду морфологических признаков. Однако единого мнения о
самостоятельности этих видов нет. В связи с этим сравнение и полная
идентификация новых видов однолетних вероник из группы V. anagallis-aquatica L. представляется актуальной. В последние годы
появилась серия работ по идентификации видов с помощью молекулярно-генетических
методов, их использование позволит точно установить таксономический ранг вновь
выделенных таксонов и докажут или опровергнут родственные связи между
представителями наземной и водной экобиоморфы группы V.
anagallis-aquatica L.
Систематика вероник из родства V. anagallis-aquatica L.как и некоторых других влаголюбивых видов,
существенно осложняется в связи с многочисленностью экологических форм,
обитающих в разных условиях увлажнения. Почти все признаки вегетативной и
генеративной сферы изменяются в широких пределах, создавая видимость
непрерывного ряда, который связывает большинство известных видов группы. В
процессе поиска признаков, пригодных для таксономических целей и построения
надежных ключей, было обнаружено, что для этого, кроме традиционно традиционно
применяемых морфологических характеристик, могут быть использованы, по мнению
Г. Ю. Клинковой, строение и распределение волосков на вегетативных и
генеративных органах. Использование характера опушения, у некоторых видов
совершенно оригинального, значительно упрощают идентификацию многих сомнительных
образцов.
Цель работы: Идентификация особей в
популяциях наземной и водной экобиоморфы V. anagallis-aquatica L. с помощью молекулярно-генетических методов.
Материалом
для исследования послужили личные сборы и гербарные образцы. Сбор материала для
молекулярно-генетического исследования и морфологического описания производился
в Кировской, Нижегородской, Ярославской, Волгоградской, Ленинградской областях,
Ямало-Ненецком АО. Морфологическое
описание растений производилось в гербариях ВятГГУ, ННГУ, МГУ, Гербария И. Л.
Мининзона, Отдела Природы Кировского областного краеведческого музея,
Ботанического института РАН им. В.Л. Комарова, Уральского стационара Института
экологии растений и животных РАН. В итоге было проанализировано несколько сотен
гербарных листов.
Основными
методами исследования были онтогенетический, сравнительно-морфологический,
структурно-функциональный, молекулярно-биологический, молекулярно-генетический
анализы.
Нуклеотидная последовательность фрагментов гена
18S рРНК была определена для V. anagallis-aquatica, V.
anagalloides, V. tenuis. Для V.
anagalloides и V.
tenuis в базе данных NCBI нуклеотидных
последовательностей исследуемого гена не обнаружено, что позволяет утверждать
первичность определения нами гена, кодирующего 18S рРНК у V.
аnagalloides и V. tenuis
Сравнение определенных нуклеотидных
последовательностей этих трёх видов показало, что наибольшим сходством
(96 %) обладали первичные структуры гена кодирующего 18S
рРНК у V. tenuis
и V. anagallis-aquatica.
Сходство V. anagalloides и V.
tenuis
составило 70,8 %, что свидетельствует об их близком родстве.
Замечательно, что у представителей одного вида V. anagallis-aquatica, произрастающих на
территории Нижегородской области и островах Новой Зеландии сходство первичных
структур гена кодирующего 18S рРНК составило 90 %. Это ещё раз подтверждает древность секции Beccabunga и её южно-азиатские корни.
Характеристика
дендрограммы сходства нуклеотидных последовательностей участка гена кодирующего
mat K представителей рода Veronicа. На основании
полученных результатов можно сделать вывод о том, что изучаемые однолетники
семенного происхождения являются гибридами в результате скрещивания двух водных
видов - вероники Beccabunga и вероники V.
anagallis-aquatica L.
При освоении
более засушливых мест (песчаных отмелей, пляжей) семенные особи проходят
онтогенез полностью в течение одного вегетационного сезона, у них не остается
нереализованных почек, в результате чего растение существует как типичный
однолетник-монокарпик. Предположительно это еще одна, гигрофильная, линия
возникновения однолетних растений. На основании вышеизложенного можно выдвинуть гипотезу о гибридном происхождении
однолетников семенного происхождения относящихся к наземной экобиоморфе от
представителей водной экобиоморфы.
После
определения видовой принадлежности из исследуемого материала выделяли
нуклеиновую кислоту. Проведено сравнение двух методов выделения, основанных на
использовании додецилсульфата натрия и реагента СТАБ
(цетилтриметиламмонийбромид). Установлено, что при использовании
додецилсульфата натрия амплификация ДНК гена, кодирующего 18S
рРНК, наблюдалась в образцах свежих листьев, а при использовании СТАБ метода в
гербарных образцах. Таким образом, с использованием двух методов выделения
хромосомной ДНК из листьев растений были наработаны фрагменты ДНК гена,
кодирующего 18S рРНК представителей V. anagalloides,
V. anagallis-aquatica L, собранных летом 2011
г. и фрагменты гена 18S рРНК представителей V.
tenuis из гербарного материала, собранного в 1968 году.
На рисунке 1 представлена амплификация ДНК гена 18S pРНК.
Для
каждого из исследуемых растений были определены участки нуклеотидной
последовательности гена, кодирующего 18S рРНК, размером
приблизительно 187 – 298 нуклеотидных оснований с 5' и 3' конца каждого из
фрагментов.
Нуклеотидные последовательности использовали для
сравнения между собой и с первичными структурами гена 18S
рРНК других представителей семейства Verоnica, доступными в базе данных
NCBI. Установлено, что для представителей видов V. anagalloides и V.
tenuis в базе данных NCBI отсутствуют нуклеотидные
последовательности исследуемого гена. Это позволяет утверждать, что первичная
структура гена, кодирующего 18S рРНК для V.
аnagalloides и V. tenuis, определена впервые.
Сравнение определенных нами нуклеотидных последовательностей между собой показало,
что наибольшим сходством обладали первичные структуры гена, кодирующего 18S
рРНК у V.
tenuis RU и V.
anagallis-aquatica RU,
которое составило 96,0 %. Сходство
первичных структур гена, кодирующего 18S рРНК, между
представителями рода Verоnica варьировало от 70,8 до 96,7%. Интересно
отметить, что у представителей одного вида V. anagallis-aquatica,
произрастающих на территории Нижегородской области и островах Новой Зеландии,
сходство первичной структуры гена, кодирующего 18S рРНК, составило
90,7 %. Данное наблюдение
свидетельствует о внутривидовой изменчивости нуклеотидных последовательностей
генома, вероятно вызванной произрастанием в изолированных друг от друга
условиях.
На рисунке 2 представлена полученная с
использованием компьютерной программы MegAlign дендрограмма сходства
нуклеотидных последовательностей гена, кодирующего 18S рРНК. Как видно из рисунка, V.
anagallis-aquatica (RU),
V. anagalloides (RU)
и V. tenuis
(RU) образовывали единый кластер с представителями видов V.
heureca (Austria),
V. beccabunga (Turkey)
и V. peregrina (Austria),
минимальное сходство между представителями которого составляло 88.8 %.
Полученные данные указывают на генетическое родство представителей секции Beccabunga
и свидетельствуют о происхождении этих видов от одного предшественника.
Расположение видов в едином кластере с представителем, произрастающим на
территории Новой Зеландии, позволяет утверждать, что формирование секции Beccabunga
произошло до отделения островов от континентальной части Евразии. Данное
наблюдение подтверждает выводы А. Г. Еленевского, который на основе анализа
морфологии и эволюции пришел к выводу о древнем происхождении секции Beccabunga
в южно-азиатской части континента.
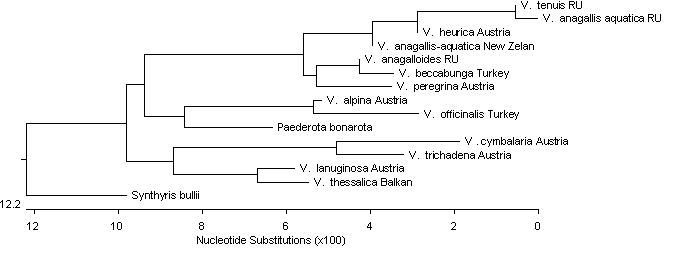

Рисунок
2 – Дендрограмма сходства нуклеотидных последовательностей участка гена
кодирующего 18S рРНК представителей семейства Veronica.
В нашем исследовании максимальное сходство
нуклеотидных последовательностей гена, кодирующего 18S рРНК, наблюдалось
между V. tenuis
и V. anagallis-aquatica ( 96,7%) и V. anagalloides и V.
beccabunga (96,2%). В то же время
максимальное сходство нуклеотидных последовательностей между другими видами не
превышало 80,0%. На дендрограмме сходства нуклеотидных последовательностей
видно, что как V. tenuis
и V. anagallis-aquatica,
так и V. anagalloides и V. beccabunga образуют между собой отдельные близкородственные
пары. По-видимому, обнаруженные различия в нуклеотидных
последовательностях этих пар связаны с различными ареалами. Представленные
данные свидетельствуют скорее в пользу
гибридного происхождения V. tenuis
и V. anagalloides от многолетников, чем о
самостоятельности данных видов. Однако для окончательного заключения необходимо
сравнение первичных структур генов пластид, которые передаются исключительно по
материнской линии.
Установлено, что при использовании
додецилсульфата натрия амплификация ДНК гена, кодирующего 18S
рРНК, наблюдалась в образцах свежих листьев, а при использовании СТАБ метода в
гербарных образцах.
Представленные данные свидетельствуют скорее в
пользу гибридного происхождения V.
tenuis и V. anagalloides от многолетников, чем о самостоятельности данных
видов.
Полученные данные указывают на генетическое
родство представителей секции Beccabunga и свидетельствуют о
происхождении этих видов от одного предшественника.
Расположение видов в едином кластере с
представителем, произрастающим на территории Новой Зеландии, позволяет
утверждать, что формирование секции Beccabunga произошло до отделения
островов от континентальной части Евразии.
Материалом
для исследования послужили личные сборы и гербарные образцы. Растения собирали
в период цветения. После чего определяли виды по справочникам (Flora Europea,
Флора СССР в 30 томах). Сбор материала для молекулярно-генетического
исследования и морфологического описания производился в Кировской области
(песчаные отмели р. Сандаловка), Нижегородской области (р. Сережа, пос. Старая
Пустынь), а так же гербарные образцы, предоставленные гербарием ННГУ им. Н. И.
Лобачевского.
Для
сравнения генетических характеристик из листьев растений представителей семейства Veronica выделяли
хлоропластную ДНК. Для выделения ДНК
использовали метод реагента СТАБ. Очищенную ДНК использовали в полимеразной цепной
реакции (ПЦР) для амплификации фрагмента нуклеотидной последовательности гена
хлоропластов – mat K. Объём реакционной смеси составлял 25 мкл. Проводили 45
циклов амплификации по следующей программе: 94°С – 60'', 94°С – 30'', 55°С –
30'', 72°С – 90'', 72°С – 5' . В реакции использовали олигонуклеотидные
праймеры mat F (5′-CCTgTCCATggAAATCTT-3′) и mat R
(5′-gTTCTAgCACAAgAAAgTCg-3′)
специфичные для гена mat K хлоропластной ДНК. Полученные в ходе
проведения ПЦР фрагменты ДНК выделяли из геля с использованием набора «DNA
Extraction Kit» производства Fermentas (ЕС) и определяли нуклеотидную
последовательность на приборе ABI Prism 3130 (США), согласно рекомендациям
производителей.
Первичная
структура ДНК фрагмента гена mat K были
определена для шести представителей рода Verоnica – V. anagalloides, V.
tenuis, V. poljensis, V. heureca, V. anagallis-aquatica, V. beccabunga . Нуклеотидные последовательности использовали
для сравнения между собой и с первичными структурами гена кодирующего mat K
представителей рода Verоnica, доступными в базе данных NCBI.
Установлено, что для представителей видов V. anagalloides, V. tenuis, V.
poljensis, V. heureca в базе данных
NCBI отсутствуют нуклеотидные последовательности исследуемого гена, что
позволяет утверждать о том что первичная структура гена кодирующего mat K для V.
аnagalloides, V. poljensis, V. tenuis, V. heureca определена впервые.
Рисунок 3.
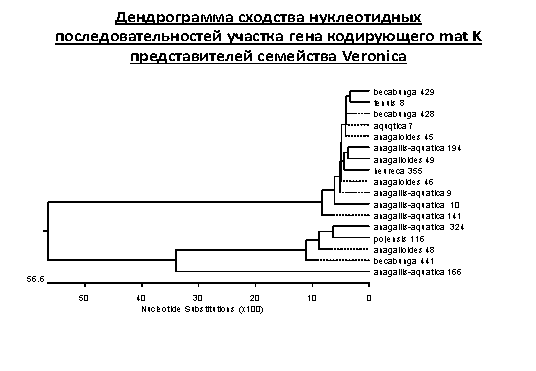
Примечание. Цифрами у видового разнообразия указан номер пробы при
исследовании, в котором зашифровано место произрастания.