Кургамбаева
Г.С., Жаппар Н.К., Ханнанов Р. А., Тен О.А., Балпанов Д.С.
Выделение железо и сероокисляющих ацидофильных
микроорганизмов перспективных для кучного выщелачивания меди.
Филиал
РГП на ПХВ «Национальный центр биотехнологии Республики Казахстан», КН МОН РК в
г. Степногорск, e-mail: ipbncbrk@mail.ru
Введение
Постоянно
истощающиеся запасы рентабельных месторождений вызывают необходимость
разработки новых высокоэффективных и экономически привлекательных методов
извлечения металлов из бедных (забалансовых) месторождений. В тоже время, в
результате промышленной деятельности в республике Казахстан накоплено много
техногенных отходов горно-обогатительного и металлургического производства -
отвалы бедных руд, хвосты обогащения, шлаки и шламы металлургического
производства. С одной стороны, отходы представляют собой большой источник
экологической опасности для окружающей среды, с другой - отвалы (продукты
переработки) по своему качественному и количественному составу часто содержат
значительные количества ценных и полезных ископаемых: золото, уран, серебро,
медь, никель и т.д. Повторное использование хвостов и шлаков позволит не только
решить экологические проблемы, но и дополнительно извлечь драгоценные металлы
[1].
На
сегодняшний день технология биовыщелачивания представляет собой наиболее
перспективный и многообещающий метод для переработки отходов обогащения руд. По
сравнению с традиционными методами он обладает рядом несомненных преимуществ –
технологическая простота, низкие энерго- и материальные затраты, обеспечивает
эффективную переработку отходов с высоким извлечением содержащихся в них ценных
металлов и не вызывает вторичных загрязнений окружающей среды [2].
За последние десятилетия
промышленное применение железо - и сероокисляющих микроорганизмов, с целью
извлечения ценных компонентов из руд, достигло широких масштабов в разных
странах. В настоящее время различными компаниями стран Северной и Южной Америк,
Африки, Австралии используются бактериально-химические технологии добычи меди,
кобальта, никеля, золота, цинка, урана [3].
Таким образом, выделение новых штаммов
железоокисляющих и сероокисляющих бактерии открывает большие возможности для
развития технологии бактериального выщелачивания цветных металлов из бедных
руд.
Материалы и методы
Объектом исследования являлась
руда и продуктивные растворы месторождения Бенкала.
Питательные
среды
Среда Сильвермана и
Люндгрена 9К:
1-й раствор: в 700 мл
дистиллированной воды растворили (г): (NH4)2SO4 – 3,0; K2HPO4 – 0,5; KCl – 0,1; MgSO4x7H2O – 0,5; Ca(NO3)2x4H2O – 0,01.
2-й раствор: в 300 мл
дистиллированной воды растворили 44,2 г FeSO4x7H2O и добавили 1мл
10н раствора серной кислоты. Среда 9КS:
1-й раствор: в 700 мл
дистиллированной воды растворяют (г): (NH4)2S04 – 0,5; МgSО4 х 7Н2О –
0,3; NaС1 – 0,2; KН2РО4 – 0,2; Са(NO3)2
х 4Н2О – 0,07.
2-й раствор: в 300 мл
дистиллированной воды растворяют 22,1 г FеSО4 х 7Н2О и
добавляют 1 мл 10 н серной кислоты. рН ≈ 1,5 - 2,5.
Среда Ваксмана, г/л:
Сера – 10,0; (NH4)2SO4 – 0,3; KH2PO4 – 3,0; CaCl2 x 6H2O – 0,25; MgSO4 x 7H2O – 0,5; FeSO4 x 7H2O – 0,01.
Растворы стерилизовали
отдельно при температуре 110 ![]() и 1 атм. в
течение 20 мин.
и 1 атм. в
течение 20 мин.
Методы
количественного учета
Количественный
учет микроорганизмов проводили методом
серийных разведений, методом прямого подсчета в камере
Горяева и методом прямого
подсчета с помощью микроскопа с фазово-контрастным устройством [4].
Культурально-биохимические
методы идентификации
Идентификацию штаммов проводили на основе
физиолого-биохимических методов [5].
Величину рН и
окислительно-восстановительный потенциал (Eh) исследуемых растворов определяли
с помощью потенциометра универсального ЭВ-74.
Методы получения накопительной культуры
и выделения изолятов.
Аликвоту технологического раствора объёмом
1000 мл центрифугировали при 4000 об/мин при +4 оС в течении 10 мин.
Супернатант декантировали. Осадок количественно перенесли в колбу Эрленмейра
объёмом 750 мл и добавили питательную среду 9К объёмом 100 мл. Колбы
инкубировали при интенсивном перемешивании при +14, 28, 42 оС.
Ежесуточно проводили отбор проб культуральной жидкости для определения
концентрации форм железа и проведения микрокопирования. Содержимое колб с
интенсивной железоокисляющей активностью пересевали в свежую питательную среду
9К объёмом 100 мл. Анализ физико-химических параметров и микрокопирование
проводили по ранее описанной схеме. Аликвоту культуральной жидкости
соответствующую шестому пересеву объёмом 1 мл перенесли в пробирку, содержащую
9 мл среды 9К. Подобным образом осуществили последовательные десятикратные
разведения до 10 шага. Пробирки инкубировали при интенсивном перемешивании при
+28 оС в течении 10 дней. 1 мл культуральной жидкости
соответствующей крайней пробирки перенесли в пробирку со свежей средой 9К
объёмом 9 мл и повторили процедуру десяти кратных разведений до 10 шага.
Аналогичные операции с десятикратными разведения повторили ещё раз.
Культуральную жидкость последней пробирки с железоокисляющей активностью
перенесли в колбу Эрленмейера содержащую среду 9К объёмом 100 мл и
культивировали при интенсивном перемешивании при 28 оС в течение 3
дней полного окисления закисного железа. Полученные культуры считали
моноизолятами.
Филогенетический анализ с помощью секвенирования 16S рРНК у выделенных моноизолятов.
Выделение ДНК
1,5 мл бактериальной культуры центрифугировали в течении 10 мин при 12
000 об/мин. Супернатант декантировали. Осадок ресуспендировали в 500 мл ТЕ
буфера. К суспензии добавили 30 мкл 10% раствора SDS и 3 мкл протеинкиназы К.
Содержимое пробирок инкубировали в течении 4 часов при температура 37 оС.
К суспензии добавили 100 мкл 5М хлорида натрия и 80 мкл раствора СТАВ/NaCl
тщательно перемешали и инкубировали 10 мин при 65 оС. Далее добавили
750 мл хлороформ/изоамилового спирта и центрифугировали 10 мин при 12 000
об/мин. Супернатант перенесли в отдельную пробирку и добавили 500 мл
фенол/хлороформ/изоамилового спирта и центрифугировали 10 мин при 12 000 об/мин. Супернатант отделили
и к нему добавили 400 мл изопропанола. Микропробирку содержащую реакционную
смесь инкубировали при 0 оС в течение 10мин после чего
центрифугировали при 12 000 об/мин в течении 10 минут. Образовавшийся
осадок промывали 70% этанолом и растворили в 50 мкл ТЕ буфера.
Амплификация фрагмента 16S рРНК гена.
Реакция ПЦР была выполнена с универсальными праймерами прямой 5’-AGAGTTTGATCCTGGCTCAG-3’ и обратного 5’-GGACTACCAGGGTATCTAAT-3’. Общий объём составлял
20 мкл. ПЦР смесь содержала 150 нг ДНК, 1 Ед. MaximaHotStartTaq ДНК полимеразы (Fermentas),
0,2 мМ каждого дНТФ, 1-х ПЦР буфер (Fermentas), 2,5 мМMgCl2, 10 пмоль каждого
праймера. Режим амплификации приведён в таблице 1.
Таблица 1. Режим амплификации
|
Стадии |
Время |
t оС |
Кол-во циклов |
|
Преденатурация |
7 мин |
95 |
1 |
|
Денатурация |
30 сек |
95 |
30 |
|
Отжиг |
40 сек |
55 |
|
|
Элонгация |
60 сек |
72 |
|
|
Заключительная
элонгация |
7 мин |
72 |
1 |
Определение
нуклеотидной последовательности
Очистку ПЦР продуктов от не связавшихся праймеров
проводили, ферментативным методом используя, экзонуклеазу I (Fermentas)
и щелочную фосфатазу (Shrimp Alkaline Phosphatase, Fermentas)
Реакцию секвенирования проводили с применением Big Dye Terminatorv 3/1 CycleSequencingKit (Applied Biosystems) согласно инструкции
производителя, с последующим разделением фрагментов на автоматическом
генетическом анализаторе 3730xlDNAAnalyzer (Applied Biosystems)
Анализ нуклеотидных последовательностей
Нуклеотидные последовательности 16S рРНК гена идентифицируемых
штаммов были проанализированы и объединены в общую последовательность в
программном обеспечении SeqScape 2.6.0 (AppliedBiosystems). После чего были удалены концевые фрагменты (нуклеотидные
последовательности праймеров, фрагменты, имеющие низкий показатель качества)
что позволило нам получить нуклеотидную последовательность протяженностью 730
п.н., которые были идентифицированы в GeneBank по алгоритму BLAST.
Построение филогенетических деревьев проводили с использованием
программного обеспечения Mega 5.2, выравнивание
нуклеотидных последовательностей проводили, использую алгоритм ClustalW,
построение филогенетических деревьев проводили с использованием ближайших
соседей (Neighbor-JoiningNJ)
Результаты и
обсуждение
Морфология выделенных изолятов.
Из образцов растворов и руд были выделены
мезофильные грамм отрицательные микроорганизмы. Морфология выделенных
микроорганизмов Клетки культуры в виде коротких палочек, расположенных
поодиночке, размером (0,3-0,4) ×
(1,2-1,6) мкм. Имеют один полярный жгутик. Микрофотография раздавленной капли
чистой культуры представлена на рисунке 1.
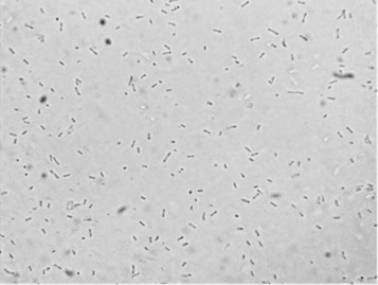
Рисунок 1. Микрофотография «раздавленной
капли» суспензии изолята FT-24.
Биохимические и физиологические характеристики.
Изоляты BF, FT-24 являются
строгими автотрофами, облигатными аэробами, не образуют спор. Размножение
происходит поперечным делением. Окисленное железо не образует, каких – либо
оформленных структур в клетках. Оптимальная температура роста 28 ºС.
Хорошо растут на питательной среде 9К, при этом рН среды снижает до 1,8-1,9.
Таксономическое положение.
С целью определения филогенетического родства на основе сравнения
нуклеотидных последовательностей фрагмента гена 16S рРНК были получены сиквенсы соответствующих участков генома. С
помощью программного приложения MEGA 5.2 были сопоставлены с
последовательностями из базы данных BLAST. Филогенетическое дерево представлено
на рисунке 2.
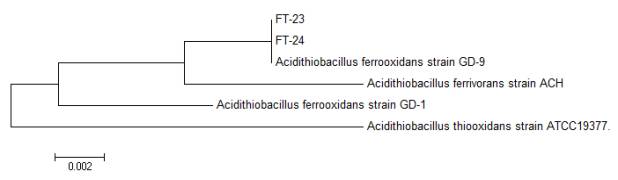
Рисунок 2. Филогенетическое дерево, построенное с использованием
алгоритма neighbor-joining на основе сравнения нуклеотидных последовательностей
генов, кодирующих 16S рРНК.
Согласно результатам сравнительного анализа гена 16S рРНК
изоляты BF и FT-24 были отнесёны к Acidithiobacillus ferroxidans. Степень
его гомологи со штаммом из базы данных GenBank GD-9
составила 100% .
Таким образом, проведенный нами филогенетический анализ, на основе
сопоставления последовательностей генов 16S РНК подтвердил
морфолого-биохимическую классификация выделенных изолятов.
Заключение
На основание морфологических,
физиолого-биохимических и генетических данных изоляты BF, FT-24 относятся к группе
мезофильных бактерий с видовой принадлежностью – Acidithiobacillus ferroxidans. Выделенные штаммы
занесены в коллекцию филиала НЦБ в г.Степногорске в качестве перспективного
микроорганизма для выщелачивания цветных металлов и благородных металлов из
колчеданных руд.
1. Муканов Д.
Металлургия Казахстана: состояние,
инновационный потенциал, тренд развития. – Алматы, 2005. – Т. 5. – 290
2. Bosecker K. Bioleaching: metal solubilization by microorganisms // FEMS
Microbiol. Rev. –1997. – V. 20.– P. 591-604.
3. Ostrowski M, Sklodowska A. Bacterial and chemical leaching pattern on
copper ores of sandstone and limestone type. // World J. Microbiol. Biotechnol.
– 1993. - № 9. –Р. 328-333.
4. Герхардт Ф. Методы общей
бактериологии: в 3 т. / пер. с англ.; под ред. Е.Н.Кондратьевой и Л.В.
Калакуцкого. – М.: Изд-во Мир, 1984. – Т. 2. – С. 450-454.
5. Sand W., Gehrke T., Jozsa P.-G., Schippers A.
(Bio) chemistry of bacterial leaching – direct vs.
indirect bioleaching // Hydrometallurgy. – 2001. – V. 59. – P. 159-175.