Кургамбаева Г.С.,
Есенбаева А.Е., Ханнанов Р. А., Тен О.А., Балпанов Д.С. Филиал РГП на ПХВ «Национальный центр биотехнологии
Республики Казахстан», КН МОН РК в г. Степногорск, e-mail: ipbncbrk@mail.ru
Выделение азотфиксирующих
микроорганизмов из почв Северного Казахстана
Введение
Интерес к
возделыванию зерновых и зернобобовых культур на территории Казахстана связан с
увеличением количества голов крупного рогатого скота и повышением спроса на
бобовые и зернобобовые культуры на внешнем рынке. Перспективными для
использования являются бобовые травы (люцерна, клевер, донник, козлятник
восточный), а также зернобобовые культуры (нут, горох, чечевица, фасоль, соя).
Азот является необходимым элементом для
всех живых организмов. Основным резервуаром азота служит земная атмосфера,
однако способностью к биологической фиксации амосферного азота обладают лишь
незначительное число микроорганизмов. Процесс связывания азота атмосферы этими микроорганизмами называется биологической азотфиксацией. Многие
животные и грибы, растения способны
вступать в симбиоз с азотфиксирующими прокариотами [1].
Азотфиксирующие симбиотические бактерии,
широко известные как Rhizobium sp., используются в производстве
биологических удобрений для бобовых растений. С развитием животноводческой
отрасли зернобобовые культуры приобрели высокую значимость в кормлении
различных видов животных в качестве источника кормового белка [2-4]. Бактерии
рода Rhizobium - строгие аэробы. Среди них различают активные, малоактивные
и неактивные культуры. Критерием активности клубеньковых бактерий служит их
способность в симбиозе с бобовым растением фиксировать атмосферный азот. Воздействие
активных штаммов симбиотических азотфиксирующих бактерий Rhizobium sp. способствует повышению синтеза у растений белковых
веществ гормональной природы (ауксинов, гиббереллинов, цитокининов),
антибиотических и антифунгальных веществ. [5,6].
В результате возникновения симбиоза растения
с азотфиксирующими микроорганизмами бобовые и зернобобовые культуры производят
на единице посевной площади больше высококачественного легкоусвояемого белка по
сравнению с культурами других семейств.
Различают и другие
виды азотфиксирующих микроорганизмов, например активные азотфиксаторы - свободно живущие микроорганизмы,
обитающие в почве и водоёмах - спороносная бактерия Clostridium. Активными
азотфиксаторами являются и многие виды сине-зелёных водорослей (Nostoc,
Апаbaena и др.), некоторые пурпурные серобактерии и зелёные бактерии. Участвуют
в фиксации атмосферного азота некоторые виды грибов, дрожжей и спирохет.
Азотфиксирующие микроорганизмы имеют очень важное значение в круговороте азота
в природе, и в частности, в снабжении доступными формами азота растений,
которые не способны усваивать его из воздуха, а получают азот после
минерализации белка.
В последние 2-3 десятилетия интерес к биологической
азотфиксации значительно возрос. Это связано не только с определяющей ролью
этого процесса в азотном балансе биосферы, но и возможностью сокращения объемов
применения минерального азота при одновременном снижении энергетических затрат
на производство продукции, что весьма актуально в свете современных тенденций
биологизации земледелия [7-9].
Препараты на основе клубеньковых бактерий
широко используются во многих странах под различными названиями (во Франции -
N-germ, в Чехии и Словакии – нитразон, а России – нитрагин, ризоторфин и т.д).
Также искусственная инокуляция бобовых культур клубеньковыми бактериями
проводится в Болгарии, Польше, США, Канаде, Франции и др.
Материалы и методы
исследований
Целью работы являлось выделение штаммов из каштановых почв
Северного Казахстана. Для выделения использовали образцы почвы. Из образцов
готовили разведения 1:100 (1 г почвы на 100 мл дистиллированной стерильной
воды) и перемешивали на шейкере в течение 2 часов. В дальнейшем проводили
десятикратные разведения с последующим высевом на чашки Петри с
агаризованной средой Эшби. Чашки культивировали при температуре 28 °С в течение
2 суток. Выросшие изолированные колонии отсевали петлей в пробирки на
поверхность скошенной плотной среды в тех же условиях.
В процессе работы использовали
универсальные, селективные и накопительные питательные среды. Выделение и
поддержание выделенных культур осуществляли на агаризованных средах. Для
отработки процесса глубинного культивирования использовали жидкие питательные
среды (без добавления агара). Ниже приведен состав питательных сред:
Питательная среда с гороховым
отваром. Состав (г/л): К2НPO4 - 1,0; MgSO4 - 0,3; сахароза - 10,0; отвар из 100 г зерен
гороха – до 1 л. pH 6,8-7,0.
Агаризованная питательная среда
Эшби г/л: сахароза - 10; MgSO4 - 0,2; NaCl - 0,2; K2HPO4 – 0,2; K2SO4
- 0.2; CaCO3 - 5,0; агар – 20; pH =7,0-7,2.
Для
выделения микроорганизмов Rhizobium sp отбирали растения
определенного вида (донник, люцерну, клевер, козлятник, горох, сою) с хорошо
развитой корневой системой и наличием активных клубеньков. Активность
клубеньков при отборе образцов определяли визуально - образование в клубеньках
легоглобина придает им красновато-розовую окраску на срезе. Неактивные
клубеньки, напротив, имеют коричневую или зеленоватую окраску.
Отобранные
образцы (клубеньки) в лабораторных условиях промывали и помещали на поверхность
питательной среды в чашке Петри, разрезали стерильным ножом, затем шпателем растирали
содержимое клубенька по поверхности питательной среды. Этим же шпателем, без
прокаливания, проводили рассев содержимого клубенька еще на 4 чашки Петри
последовательно.
Для
выделения Rhizobium sp из клубеньков
гороха и клевера использовали питательную среду на гороховом отваре, для
выделения Agrobacterium tumefaciens – питательную среду
Эшби.
Отбор
моноизолятов проводили на 3-4 сутки.
Колонии отбирали по типичному внешнему виду: на плотных питательных
средах в чашках Петри через 36-48 часов роста при 28 (±1)°С образовывались
слизистые белесоватые колонии диаметром 2-3 мм. Выделенные изоляты представляют
собой мелкие подвижные палочки с закругленными краями, расположенные в мазке
хаотично. Моноизоляты отсевали на скошенную питательную среду на гороховом
отваре и среду Эшби.
По
результатам теста отобраны 10 изолятов,
культурально-морфологические свойства которых указаны в таблице 1.
Таблица 1. Культурально-морфологические признаки выделенных изолятов
|
Номер изолята |
Результаты
микроскопии |
|
Z-1 |
Мелкие овальные палочки с закругленными концами,
мазке расположенны хаотично, подвижные.
Слизистые колонии прозрачного цвета. |
|
Z-2 |
Мелкие
палочки с закругленными концами, мазке расположенны хаотично,
подвижные. Слизистые колонии прозрачного цвета. |
|
Z-3 |
Мелкие
палочки с закругленными концами, мазке расположенны хаотично,
подвижные. Слизистые колонии прозрачного цвета. |
|
Z-4 |
Мелкие
палочки с закругленными концами, мазке расположенны хаотично,
подвижные. Слизистые колонии прозрачного цвета. |
|
Z-5 |
Мелкие овальные палочки с закругленными концами,
мазке расположенны хаотично, подвижные. Слизистые колонии прозрачного цвета. |
|
Z-6 |
Мелкие овальные палочки с закругленными концами,
мазке расположенны хаотично, подвижные. Слизистые колонии прозрачного цвета. |
|
Z-8 |
Мелкие овальные палочки с закругленными концами,
мазке расположенны хаотично, подвижные. Слизистые колонии прозрачного цвета. |
|
Z-9 |
Мелкие овальные палочки с закругленными концами,
мазке расположенны хаотично, подвижные. Слизистые колонии прозрачного цвета. |
|
Z-10 |
Мелкие овальные палочки с закругленными концами,
мазке расположенны хаотично, подвижные. Слизистые колонии прозрачного цвета. |
|
Z-11 |
Мелкие палочки с закругленными концами, мазке
расположенны хаотично, подвижные. Слизистые колонии прозрачного цвета. |
В
дальнейшем было проведено изучение физиолого-биохимических свойсв выделенных
моноизолятов. Результаты физиолого-биохимического анализа выделенных
моноизолятов представлены в таблице 2.
Таблица
2- Определение
биохимических свойств изолятов способом сбраживания сахаров
|
Сахара |
Азотфиксирующие
микроорганизмы |
|||||||||
|
Z-1 |
Z-2 |
Z-3 |
Z-4 |
Z-5 |
Z-6 |
Z-8 |
Z-9 |
Z-10 |
Z-11 |
|
|
Арабиноза |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
|
Целлобиоза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Фруктоза |
+ |
- |
+ |
+ |
+ |
+ |
+ |
+ |
± |
+ |
|
Галактоза |
+ |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
+ |
|
Лактоза |
+ |
+ |
± |
+ |
- |
+ |
+ |
+ |
+ |
+ |
|
Мальтоза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Маннит |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Манноза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Раффиноза |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
- |
|
Сахароза |
+ |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Трегалоза |
± |
+ |
+ |
+ |
± |
+ |
+ |
± |
+ |
+ |
|
Ксилоза |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
± |
По физиолого-биохимическим и
культурально-морфологическим признакам изоляты, выделенные из почв идентифицированы как
представители вида Agrobacterium tumefaciens - Z-1,
Z-2, Z-4, Z-9, Z-11 и
Rhizobium pusense Z-3, Z-5, Z-6, Z-8, Z-10 [10-11].
В дальнейшем исследовали
генетическое родство выделенных штаммов. С этой целью определяли
филогенетическое родство на основе сравнения нуклеотидных последовательностей
фрагмента гена 16S рРНК. С помощью программного приложения MEGA 4.0 были сопоставлены с
последовательностями из базы данных BLAST. Филогенетические древа представлены
на рисунках 1,2.
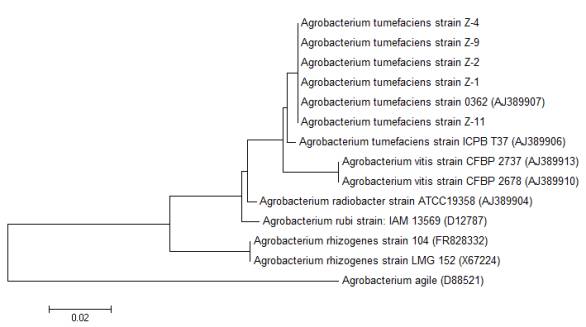
Рисунок
1. Филогенетическое дерево изолятов Agrobacterium tumefaciens Z-1,
Z-2, Z-4, Z-9, Z-11
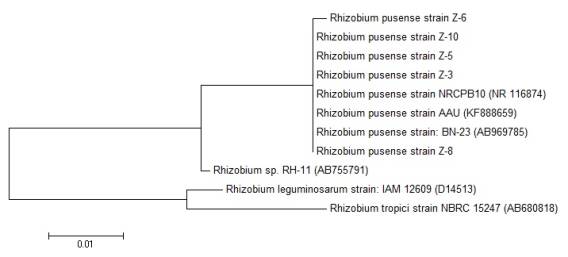
Рисунок
2. Филогенетическое дерево изолятов Rhizobium pusense Z-3, Z-5, Z-6, Z-8, Z-10
Согласно результатам
сравнительного анализа гена 16S рРНК штаммы Z-1,
Z-2, Z-4, Z-9, Z-11 были отнесены к
Agrobacterium tumefaciens. Степень его гомологи с
референсными последовательностями (AJ 389907) составила 100%. Изоляты
Z-3, Z-5,
Z-6, Z-8, Z-10 были отнесены к Rhizobium
pusense, степень его гомологи с
референсными последовательностями (NR 116874), (KF 888659), (AB 969785) составило 99%.
Таким образом, проведенный
нами филогенетический анализ, на основе сопоставления последовательностей генов
16S рРНК подтвердил морфолого-биохимическую классификацию выделенных
изолятов.
Выводы
Таким образом, в результате проделанной
работы отработан метод выделения азотфиксирующих микроорганизмов, идентификацию
которых проводили до вида по биохимическим и культурально-морфологическим
признакам с подтверждением сопоставления
последовательностей генов 16S рРНК. На
основе полученных данных изоляты Z-1, Z-2,
Z-4, Z-9, Z-11 азотфиксирующих микроорганизмов относящиеся к Agrobacterium
tumefaciens. Изоляты Z-3, Z-5,
Z-6, Z-8, Z-10 относятся к виду Rhizobium pusense.
Литература:
1.
Игнатов
В.В. Биологическая фиксация
азота и азотфиксаторы // Соросовский образовательный журнал. 1998.
2.
Косолапов В.М. Фицев А.И., Гаганов А.П.,
Мамаев М.В. Горох, люпин, вика, бобы: оценка и использование в кормлении
сельскохозяйственных животных. – Москва, 2009.
3.
Карагуйшиева Д.К. Свободноживущие азотфиксаторы почв Казахстана / Алма-Ата: Наука, 1972. - 199
с.
4.
Мамилов Ш.З. Азотфиксирующие
ассоциации с Rhodopseudomonas sp. в затопляемых почвах под рисом. // Повышение
плодородия почв рисовых полей. М.: Наука. - 1977. -С. 116-121.
5.
Илялетдинов А.Н.
Микробиологические превращения азотсодержащих соединений в почве / Алма-Ата,
Наука, 1976.-281 с.
6.
Fisher Hans-Martin. Genetic Regulation of Nitrogen fixation in Rhizobia//
Microbioligical reviews.-September, 1994. –Р. 352-386.
7.
V.V. Deshmukh, S.S. Mane, R.M. Gade, R.W. Ingle, M.S. Joshi. Biochemical
studies of Bradyrhizobium japonicum isolates // American international Journal
of Research in Formal, Applied and Natural Sciences. – 2013. - Vol. - 4(1). P.
53-57.
8.
S.M. Nour, M.P. Fernandez, Ph. Normand, J-C. Cleyet-Marel. Rhizobium
ciceri sp. Nov., Consisting of strains that nodulate Chickpeas (Cicer
arithenium L.) // International Journal of Systematic Bacteriology.- 1994.-
Vol.- 44. No.- 3. P. 511-522.
9.
M.J. Sadowsky, H.H. Keyser, B.B. Bohlool. Biochemical characterization
of fast- and slow-growing rhizobia that nodulate soybeans // International
Journal of Systematic Bacteriology.- 1983.-
Vol.- 33. No.- 4. P. 716-722.
10.
V.K. Deshwal, A. Chaubey. Isolation and Characterization of Rhizobium
leguminosarum from Root nodule of Pisum
sativum L. // Journal of Academia and Industrial Research (JAIR). – 2014. –
Vol. 2. – Р. 464-467.
11.
F. Shahzad, M. Shafee, F. Abbas, S. Babar, M.M. Tariq, Z. Ahmad.
Isolation and biochemical characterization of Rhizobium meliloti from root
nodules Alfalfa (Medico sativa) // The Journal of Animal and Plant Sciences. –
2012. Vol. - 22(2). P. 522-524.