химия и химические технологии
Теоретическая химия.
к.х.н. Хакимова
Д.К., к.х.н. Шарипов Д.Ш.,.
Насриддинов С.,
Рузматова Г.К., Эшанкулов Х.
Таджикский технический университет им.акад.М.Осими
Термическая устойчивость и
термодинамические характеристики гидрофторида лития
В системе HF-LiF-H2O было установлено до 75% HF существования
только одного гидрофторида состава LiF-HF. При комнатной
температуре на воздухе он постепенно теряет фтористый водород, превращаясь в LiF. Температура
его разложения равна 129,5оС.
Мы изучали реакцию взаимодействия
карбоната лития с плавиковой кислотой в калориметре растворения, для изучения
термодинамики образования гидрофторида лития и нахождения энтальпии ![]() Но298 LiF.HF.
Но298 LiF.HF.
Для калориметрических опытов
использовались: карбонат лития марки «ОСЧ», его навеска около 0,2-0,4г.,
плавиковая кислота марки «ОСЧ» 45%-ной концентрации и разбавлением
дистиллированной водой готовились растворы других концентраций. Перед каждым
опытом по растворению карбоната проводилась градуировка калориметра
электрическим методом. Визуально нами
определено, что гидрофторид лития образуется лишь при взаимодействии карбоната
лития с плавиковой кислотой с концентрацией 40% и выше, и определено, что при реакции выделяется
120,24 кДж/моль. Термохимическое уравнение этого процесса выглядит так :
Li2CO3 + 4HF = 2LiF. HF + H2O + CO2
Используя зависимость энтальпии
образования плавиковой кислоты от
разбавления раствора, энтальпии образования продуктов реакции и
энтальпии образования Li2CO3, мы рассчитали
величину энтальпии образования гидрофторида лития LiF.HF, она равна 934,29 кДж/моль.
Продолжая исследования гидрофторида
лития для получения термодинамической характеристики и сопоставлении с
калориметрическими данными, мы использовали тензиметрический метод с мембранным
нуль манометром. Давление пара измерялось с точностью ![]() 0,2 мм.рт.ст., температура
0,2 мм.рт.ст., температура ![]() 0,5 градусов. Гидрофторид лития синтезировался нами при
взаимодействии 43%-ного раствора HF с карбонатом лития по указанной
схеме.
0,5 градусов. Гидрофторид лития синтезировался нами при
взаимодействии 43%-ного раствора HF с карбонатом лития по указанной
схеме.
При
исследовании термической устойчивости гидрофторида лития в мембранную
камеру помещали воздушно-сухую навеску с таким расчетом, чтобы при 100оС
общее давление в системе было равно 1атм. Измерение проводилось в масляном
термостате для уменьшения погрешности нагрева и быстрого достижения процесса
равновесия. При температуре 111оС значение давления составляет 689
мм.рт.ст. При охлаждении значение давления хорошо согласуются со значениями
давления при нагреве. Таким образом, процесс сводится к образованию
фтороводорода, и тогда выражение константы равновесия принимает такой вид: К = Робщ = РHF.
На основании экспериментальных данных по
методу наименьших квадратов определено уравнение зависимости давления от
температуры для процесса:
[LiF.HF]тв = [LiF]тв + (HF)г
lgPмм.рт.ст.= 10,11 ![]() 0,15 -
0,15 -![]()
Из уравнения найдены величины 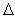 Но и
Но и 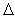 Sо
процесса
Sо
процесса
![]() Но = 52,17
Но = 52,17![]() 2,09 кДж/моль
2,09 кДж/моль
![]() So = 138,45
So = 138,45 ![]() 7,10 Дж/моль .град
7,10 Дж/моль .град
Для сопоставления калориметрических и
тензиметрических данных, используя ![]() Но процесса
разложения гидрофторида лития, которые получены нами в результате тензиметрии,
энтальпии образования фторида лития и энтальпии образования плавиковой кислоты
от разбавления раствора, была рассчитана
Но процесса
разложения гидрофторида лития, которые получены нами в результате тензиметрии,
энтальпии образования фторида лития и энтальпии образования плавиковой кислоты
от разбавления раствора, была рассчитана ![]() Но298 – энтальпия
образования гидрофторида лития по следующей схеме:
Но298 – энтальпия
образования гидрофторида лития по следующей схеме:
LiF .HF[тв] = LiF[тв] + HF(г), ![]() H=52,17
H=52,17![]() 2,09 кДж/моль
2,09 кДж/моль
Она равна 885,77 кДж/моль. Как
видно, рассчитанная величина энтальпии гидрофторида лития хорошо согласуется с
полученной энтальпией по калориметрическому опыту – 934,29 кДж/моль.
Таким образом, исходя из
калориметрического исследования взаимодействия карбоната лития с плавиковой
кислотой и исследования термической устойчивости гидрофторида лития, нами
сделаны следующие выводы:
1.Тепловой эффект реакции составляет 120,24 кДж/моль.
2.Подтверждена возможность образования
гидрофторида лития LiF.HF при взаимодействии
карбоната лития с концентрированными растворами плавиковой кислоты в условиях
калориметрического опыта.
3. Найдена величина энтальпии
образования гидрофторида лития LiF.HF =934,29
кДж/моль.
4. Определена термодинамическая
характеристика процесса термического разложения гидрофторида лития:
![]() Но = 52,17
Но = 52,17![]() 2,09 кДж/моль
2,09 кДж/моль
![]() So = 138,45
So = 138,45 ![]() 7,10 Дж/моль .град
7,10 Дж/моль .град