Д.А.Писаненко, О.К.Гриб
Национальный технический университет Украины
«Киевский политехнический институт»
Пестицидные свойства 2- и 4-(2-циклопентенил)фенолов и их алкиловых
эфиров
dpisanenko@mail.ru
Для повышения
продуктивности сельского хозяйства важное значение имеют пестициды – химические
средства защиты растений. Несмотря на большое количество существующих
пестицидов [1], разработка новых препаратов на основе доступных промышленных
реагентов может представить практический интерес. К таким препаратам можно
отнести замещенные фенолы и их алкиловые эфиры с кратной связью в боковой цепи,
наличие которой определяет их биологическую активность и способность к
окислительному расщеплению [2]. В патенте [3] приведены краткие данные об
инсектицидной активности циклопентенилфенолов – продуктов реакции фенола с
1,3-циклопентадиеном. Учитывая доступность указанных реагентов, представляет
интерес более детальное изучение синтеза таких фенолов и алкиловых эфиров на их
основе с целью последующего исследования их пестицидных свойств. Для этого нами
были синтезированы нижеприведенные соединения (1-5):
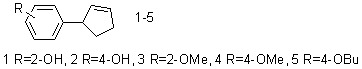
Для синтеза фенолов (1-2) был использован известный ранее лабораторный метод [4] алкенилирования фенола 1,3-циклопентадиеном. С целью повышения выхода продуктов в промышленных условиях мы проводили реакцию в растворителе – толуоле и применяли катализатор – безводную полифосфорную кислоту при молярном соотношении фенола и 1,3-циклопентадиена равном 3:1. Реакцию проводили при 10-15оС в течение 12-16 часов, выход смеси фенолов (1-2) (соотношение 20:80) составлял 80%. Кристаллический фенол (2) легко отделялся при охлаждении, фракционированием алкилата в вакууме 1-2 мм рт.ст. выделяли хроматографический чистый фенол (1) (ГЖХ проводили на приборе Цвет-4 с пламенно-ионизационным детектором, колонка 4х1000мм, 10% апиезона L на хромосорбе W). Алкиловые эфиры (3-5) получали как алкенилированием анизола и н.бутилового эфира фенола 1,3-циклопентадиеном [5], так и О-алкилированием фенолов (1-2) алкилбромидами в присутствии этилата натрия по известным методам [6].
Пестицидные
свойства синтезированных соединений (1-5) изучали по стандартным методикам,
принятым при проведении скрининговых исследований. Контактную инсектицидную
активность по отношению к рисовому долгоносику, личинкам и имаго комнатных мух,
черной свекловичной тле исследовали методом индивидуальной обработки насекомых
и контактированием их с поверхностями чашек Петри, обработанных соединениями
(1-5). Акарицидное действие изучалось на паутинном клеще методом опрыскивания
растворами верхней части листьев фасоли. В опытах с паутинным клещом
использовали 0,1%-ные, с тлей –0,01%-ные, а с рисовым долгоносиком, личинками и
имаго комнатных мух – 1%-ные растворы веществ. Результаты опытов представлены в
таблице 1.
Таблица 1
Инсектицидные свойства соединений (1-5)
|
Соединение |
Гибель насекомых, % |
|||
|
Комнатные мухи |
Жуки рисового долгоносика |
Черная свекловичная тля |
Паутинный клещ |
|
|
1 |
0 |
45 |
37 |
47 |
|
2 |
26 |
100 |
25 |
29 |
|
3 |
0 |
8 |
30 |
20 |
|
4 |
0 |
28 |
30 |
20 |
|
5 |
0 |
8 |
30 |
20 |
Бактерицидную и фунгицидную активность соединений (1-5) изучали на 8 тест-объектах: Xanthomonas malvacearus, Fusarium moniliforme, Verticillium dahliae, Veuturia inaequalis, Botrytis cinerea, Aspergillus niger, Sphacelotheca panici-miliacei, Phythopthora infestans (таблица 2).
Таблица 2
Бактерицидные и фунгицидные свойства
соединений (1-5)
|
соединение |
Подавление роста, % |
Подавление развития болезни, % |
||||||||
|
Колоний бактерий и грибов |
Спор грибов |
Мучнистая роса огурцов |
Бурая ржавчина пшеницы |
|||||||
|
Xanthomonas malvacearus |
Fusarium moniliforme |
Verticillium dahlias |
Venturia inaequalis |
Botrytis cinerea |
Aspergillus niger |
Sphacelotheca panici-miliacei |
Phytophthora infestans |
|||
|
1 |
29 |
51 |
0 |
28 |
66 |
47 |
58 |
20 |
18 |
- |
|
2 |
15 |
60 |
57 |
47 |
48 |
57 |
18 |
53 |
- |
- |
|
3 |
31 |
16 |
0 |
5 |
30 |
4 |
19 |
6 |
26 |
9 |
|
4 |
21 |
0 |
5 |
11 |
0 |
8 |
- |
16 |
64 |
29 |
|
5 |
5 |
32 |
0 |
5 |
26 |
16 |
2 |
16 |
55 |
39 |
Для исследования действия
соединений (1-5) против колоний бактерий и грибов использовали 0,003%-ные
растворы, а против спор грибов –0,001%-ные. Как видно из таблицы 2, торможение
роста мицелия грибов на твердой питательной среде достигает 47-66%, а
прорастание спор грибов снижалось на 53-58% по сравнению с 95%-ным подавлением
эталоном – цинебом. Существенная активность наблюдается в борьбе с мучнистой
росой огурцов, подавляя развитие болезни на 55-64%.
Гербицидная активность соединений (1-5) была изучена на 11 тест-объектах в дозе 5 кг/га при опрыскивании зеленой массы вегетатирующих растений. Фенолы (1) и (2) на 88 и 100% подавляли рост гречихи, а фенол (2), кроме того, на 100% вызывал гибель редиса и льна и на 58% капусты и свеклы. Одновременно установлена избирательная устойчивость к этим соединениям подсолнечника, сорго и сои.
Для одного из синтезированных соединений – фенола (2) были исследованы токсичные свойства. На основе первичных опытов по изучению острой и подострой токсичности можно сделать вывод, что соединение (2) относится к малоопасным веществам. При введении в желудочно-кишечный тракт ЛД50 для крыс-самок составляет 7090 мг/кг, для мышей –1230,9 мг/кг.
Таким образом, соединения (1-5), проявляющие широкий спектр пестицидной активности и невысокую токсичность, представляют интерес для поиска среди них препаратов для борьбы с сорняками, вредителями и болезнями растений.
Литература:
1. Справочник по пестицидам.Под ред.А.В.Павлова.Киев: Урожай, 1986. 432 с.
2. Теддер Дж., Нехватал А., Джубб А. Промышленная органическая химия: Пер. с англ. под ред.О.В.Корсунского.М.: Мир, 1977. 700 с.
3. Пат.ФРГ
1768930.Verfahren zur Herstellung von
Cyclopent-2-enylphenolen.-РЖХим., 1979, №6, О509.
4. Bader A. // J.Am.Chem.Soc.-1953.-V.75.-N23.-P.5967-5969.
5. Сребродольская И.И., Писаненко Д.А., Смирнов-Замков Ю.И. // Изв.вузов, Химия и хим.технология.-1975.-Т.18.-Вып.3.-С.491-493.
6. Вейганд-Хильгетаг. Методы эксперимента в органической химии. М.: Химия, 1968. 944 с.