К.х.н. Великанова И.А.
Белорусский государственный технологический университет, Беларусь
Коррозионные свойства композиционных анодов
с активным покрытием из оксидов металлов
в сернокислом растворе
Важным условием эффективного использования
электродных материалов в электрохимических процессах является их коррозионная
стойкость при длительной эксплуатации.
Композиционные
оксидные электроды получены путем термического
разложения гексахлориридиевой кислоты, тетрахлорида титана, нитратов кобальта,
никеля, марганца [1, 2]. В качестве подложки использован листовой титан марки ВТ 1-0.
Коррозионную стойкость
электродных материалов оценивали по величине плотности тока коррозии,
определяемой методом снятия потенциостатических поляризационных кривых и
экстраполяцией тафелевских участков анодной и катодной ветвей до стационарного
потенциала.
Установлено, что среди исследуемых
электродов наименьшими токами коррозии в 0,5
М растворе H2SO4 характеризуются IrOx–TiOx/Ti и
IrOx– TiOx–CoxOy/Ti электроды (таблица).
Таблица – Плотность
тока коррозии электродных материалов
|
Электрод |
Плотность тока коррозии, А/см2 |
|
IrOx/Ti |
2,1·10-10 |
|
IrOx–TiOx/Ti
(40 мол. % IrOx) |
3,98·10-13 |
|
IrOx–CoxOy/Ti
(10 мол. % IrOx) |
2,51·10-8 |
|
IrOx–MnxOy/Ti
(10 мол. % IrOx) |
7,62·10-7 |
|
IrOx–NixOy/Ti
(10 мол. % IrOx) |
8,22·10-8 |
|
IrOx–
TiOx–CoxOy/Ti (10 мол. % IrOx, 40 мол. % TiOx) |
1,54·10-13 |
|
IrOx–
TiOx–NixOy/Ti (10 мол. % IrOx, 40 мол. % TiOx) |
6,24·10-12 |
|
IrOx–
TiOx–MnxOy/Ti (10 мол. % IrOx, 40 мол. % TiOx) |
3,45·10-10 |
С целью исследования стабильности работы
композиционных анодов
в 0,5 М растворе H2SO4 проводили
анодную поляризацию при постоянной плотности тока, при этом фиксировали время
до начала резкого увеличения потенциала (в 5–6 раз по сравнению со значением
потенциала в первоначальный момент электролиза). Ресурсные показали, что наибольшей
стабильностью в 0,5 М растворе H2SO4 обладает
IrOx– TiOx–CoxOy/Ti электрод (содержание
оксида иридия 10 мол. %, 3 г/м2 ), а наименьшей – IrOx–MnxOy/Ti электрод. При этом
наличие оксидов титана в активном покрытии увеличивает коррозионную стойкость
электродов.
С целью повышения ресурса работы
электродов активную массу покрытия увеличили в 3 раза. Исследование проводили
на электроде, проявившем наибольшую коррозионную стойкость (IrOx– TiOx–CoxOy/Ti), в 0,5 М
H2SO4 до резкого увеличения потенциала в условиях
прерывания тока (8 ч работы электрода под током, 16 ч перерыв). Увеличение
активной массы покрытия привело к увеличению срока службы анода до 100 ч, то
есть в 5,4 раза. При этом за 100 часов происходило незначительное изменение потенциала
в течение всего времени электролиза (рисунок 1).
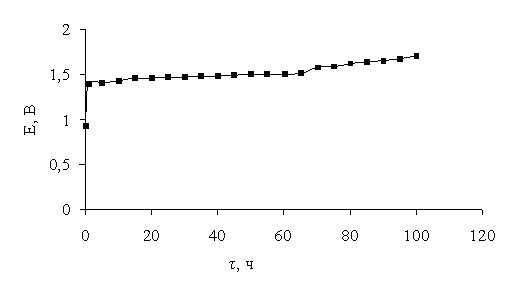
Рисунок 1– Зависимость потенциала IrOx– TiOx–CoxOy/Ti электрода от
времени
в 0,5 М растворе H2SO4 при анодной плотности тока 50 мА/см2
После ресурсных испытаний проводили также
исследование морфологии поверхности IrOx– TiOx–CoxOy/Ti электрода с
использованием сканирующего электронного микроскопа.
Электронно-микроскопические снимки поверхности электрода показали, что после
анодной поляризации (100 ч) появляются непокрытые слоем катализатора участки
поверхности титановой основы. После длительной анодной поляризации (208 ч) на
поверхности электрода остаются лишь небольшие фрагменты активного покрытия
(рисунок 2).

Рисунок 2 – Электронно-микроскопический
снимок поверхности
IrOx–TiOx–CoxOy/Ti электрода
после анодной поляризации
в 0,5 М растворе H2SO4 при плотности тока 50 мА/см2
в течение 208 ч
Таким образом, разрушение активного
покрытия может быть обусловлено несколькими причинами: механическим разрушением
выделяющимися газами и анодным подтравливанием активного покрытия. Такой
совместный механизм наиболее вероятен, поскольку скорость анодной коррозии
значительно меньше скорости механического разрушения электрода.
Литература:
1.
Великанова И.А., Иванова Н.П., Жарский И.М. Влияние условий синтеза на электрохимическую
активность оксидных иридиево-титановых электродов // Электрохимия. – 2008. – Т. 44, №. 7.
– С. 914–918.
2.
Великанова И.А., Иванова
Н.П., Жарский И.М. Анод с активным покрытием на основе оксидов иридия и титана
// Труды БГТУ. Сер. III. Химия и технология неорган.
в-в. – 2007. – Вып. XV. – С. 105–107.