Медицина /7
асп. Штейнгауэр А.Б.,
студ. Фомина М.А., д.т.н., проф. Родионов И.В., к.т.н., доц. Фомин А.А.
Саратовский
государственный технический университет
имени Гагарина Ю.А.,
Россия
Статья подготовлена при
финансовой поддержке Минобрнауки РФ
в рамках ФЦП «Научные и
научно-педагогические кадры инновационной России» на 2009–2013 годы, соглашение
№ 14.B37.21.0571.
Наноструктура биосовместимых
покрытий TiO2,
полученных на чрескостных
остеофиксаторах при обработке ТВЧ
Остеофиксаторы
представляют собой ортопедические металлоконструкции из титановых сплавов (ВТ6,
ВТ16) или нержавеющей хромоникелевой стали (12Х18Н9Т, 12Х18Н10Т) [1].
Поверхность данных конструкций помимо биосовместимости
должна иметь необходимую структуру как на микроуровне, так и в нанодиапазоне.
Многие исследования показывают, что нанометровые показатели структуры
поверхности повышают механические свойства, например твердость,
износостойкость, а также биологическую активность
[2]. Наноструктурная модификация поверхностного слоя, в основном, осуществляется
физическими (PVD) и химическими (CVD) методами вакуумно-конденсационного осаждения [3]. Главные недостатки данных способов связаны
со сложностью технологического процесса и необходимостью использования
дорогостоящего оборудования и сырья.
В связи с этим целью
данной работы является разработка альтернативной энергосберегающей технологии
наноструктурирования поверхности медицинских титановых сплавов за счет
легкоуправляемого теплофизического воздействия токов высокой частоты (ТВЧ) в
окислительной среде, определение
факторов, влияющих на параметры биомеханической совместимости и структурной
организации поверхности при индукционно-термической обработке (ИТО).
Методика исследования
На
стержневых остеофиксаторах из титанового сплава ВТ16, имеющих диаметр 4 мм
и длину внутрикостной части 15 мм, формировались биокерамические покрытия
диоксида титана TiO2 игольчатой структуры методом ИТО с помощью
лабораторной установки нагрева ТВЧ. Металлическая основа остеофиксаторов
изготавливалась механической обработкой (токарно-винторезной), далее
производилась очистка от жировых загрязнений, пескоструйная обработка и
заключительная очистка от частиц абразива в ультразвуковой ванне. Потребляемая
электрическая мощность при ИТО в резонансном режиме на частоте 100 ± 20 кГц
не превышала 0,4 кВт. ИТО проводилась в температурном диапазоне 600…800 °C, длительность процесса ИТО составляла от 30 до 120 сек.
Термический цикл ИТО включал интенсивный нагрев до заданной температуры,
выдержку и последующее охлаждение титановых образцов.
Исследования поверхностной структуры формируемых
покрытий TiO2 проводились с использованием растровой электронной
микроскопии (РЭМ) в сочетании с энергодисперсионным рентгенфлуоресцентным
анализом (ЭДРФA). Фазово-структурное состояние покрытий
определялось методом рентгенофазового анализа. Механические свойства оценивались
методом наноиндентирования, позволяющим исследовать тонкие покрытия при малых
(от 0,5 до 10 мН) значениях нагрузки. Проверка биосовместимости
остеофиксаторов с экспериментальными покрытиями из наноструктурированного
диоксида титана предусматривала тест in vivo на животных (кролики породы
«серый великан»). По истечении 30 дней клинических испытаний животные
выводились из эксперимента.
Результаты исследования
и их анализ
Получаемые металлооксидные покрытия представляют
собой различные варианты структурной организации диоксида титана в фазе рутила
(рис. 1).
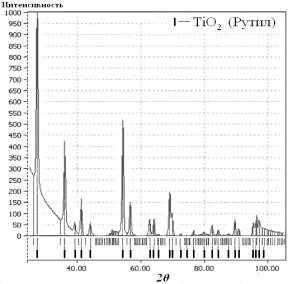
Рис.
1. Дифрактограмма покрытия
Морфология
поверхности в микрометровом масштабе характеризуется геометрическими
показателями сходными с параметрами поверхности после пескоструйной обработки
(рис. 2 а).
В нанометровом диапазоне исследования морфология представлена игольчатыми кристаллами
(рис. 2 в).

а
б в
Рис. 2. Оксидное покрытие, полученное при 600 °C в течение 60 сек:
а – микроструктура, б – субмикрометровая структура, в – наноструктура
Таблица 1
ЭДРФА покрытий на титановых остеофиксаторах
|
Режим ИТО |
Элементный состав покрытия |
|||
|
Температура, °C |
Длительность, с |
Ti |
O |
Al и следы примесей
сплава |
|
600 |
1 |
85,99 ± 2,59 |
13,70 ± 2,59 |
0,32 ± 0,03 |
|
30 |
82,90 ± 3,15 |
16,83 ± 3,17 |
0,26 ± 0,05 |
|
|
120 |
82,15 ± 2,44 |
17,54 ± 2,44 |
0,31 ± 0,06 |
|
|
300 |
80,25 ± 3,30 |
19,46 ± 3,32 |
0,28 ± 0,04 |
|
|
800 |
1 |
74,35 ± 2,32 |
25,40 ± 2,33 |
0,24 ± 0,03 |
|
30 |
63,05 ± 2,58 |
36,74 ± 2,61 |
0,21 ± 0,04 |
|
|
120 |
61,49 ± 1,93 |
38,23 ± 1,92 |
0,28 ± 0,03 |
|
|
300 |
57,51 ± 1,18 |
42,17 ± 1,24 |
0,32 ± 0,08 |
|
Химический
состав покрытий, полученных при различной длительности процесса ИТО, показан в
таблице 1. С увеличением длительности процесса ИТО содержание кислорода в
покрытии возрастает на 6 % при 600 °C и примерно на 17 % при 800 °C. Наиболее интенсивно
процесс оксидирования протекает на стадии нагрева.
Механические свойства, представленные твердостью
в нанодиапазоне, находятся в диапазоне 4,9…7,3 ( ± 40 %) ГПа. Характерная кривая зависимости нагрузки от
глубины индентирования представлена на рисунке 3. На диаграмме в
левом верхнем углу указываются параметры процесса измерения механических
свойств: максимальная нагрузка [мН], максимальная глубина [нм], твердость
[ГПа], число твердости по Виккерсу [HV], модуль упругости
[ГПа], твердость по Мартенсу [ГПа].
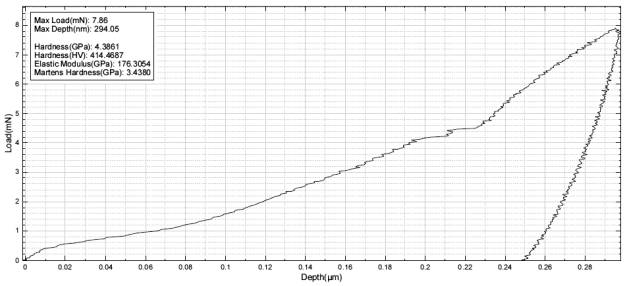
Рис. 3. Диаграмма
определения механических свойств покрытия
Проверка биосовместимости получаемых покрытий TiO2 показала, что высокая
морфологическая гетерогенность поверхностной структуры позволяет обеспечить
прочное закрепление костной ткани (рис. 4). Развитая морфология игольчатой
структуры покрытий стимулирует образование единого комплекса
«остеофиксатор – биосовместимое покрытие – костная
ткань». Многочисленные нанометровые поры не препятствуют проникновению
клеточных структур, а, напротив, способствуют процессу остеоинтеграции. На
приведенных ниже изображениях костный регенерат представлен светлыми диффузно
рассеивающимися образованиями неправильной формы (рис. 4; нижние фрагменты).

Рис. 4. Остеофиксатор c покрытием после испытаний in vivo
(режимы ИТО: температура 800 °C; продолжительность 120 сек)
В результате анализа данных изображений
установлено, что костные структуры закрепляются как на макро- (гребни резьбы
специального профиля), так и на микрометровых образованиях (выступах),
поверхность которых равномерно покрыта игольчатыми кристаллитами диоксида
титана. Таким образом, можно утверждать, что данные покрытия на основе TiO2 характеризуются высокой
биомеханической совместимостью, а именно геометрической биоактивностью в
сочетании с высокими показателями твердости.
Результаты исследования и анализ влияния температурных
режимов ИТО на морфологическую гетерогенность микро- и наноструктуры позволяют
разработать технологические рекомендации по модификации поверхности медико-технических
изделий из титана, например, остеофиксаторов и других костных имплантатов.
Тонкослойное покрытие TiO2 с игольчатой
кристаллической нанометровой структурой характеризуется высокой биосовместимостью,
что подтверждено серией экспериментов in vivo.
Литература
1. Paital S.R.,
Dahotre N.B. Calcium phosphate coatings for bio-implant applications: Materials,
performance factors, and methodologies // Materials Science and Engineering R.
№ 66, 2009. pp. 1-70.
2.
Catledge S.A.,
Fries M., Vohra Y.K. Nanostructured surface modifications for biomedical implants
// Encyclopedia of Nanoscience and Nanotechnology, Vol. 1. 2004. pp. 741-762.
3.
Fomin A.A., Steinhauer A.B., Lyasnikov V.N., Wenig S.B., Zakharevich A.M. Nanocrystalline structure of the surface
layer of plasma-sprayed hydroxyapatite coatings obtained upon preliminary induction heat treatment of metal base // Technical Physics Letters, Vol. 38. № 5.
2012. pp. 481-483.