Киракосян Р.Н., д.б.н.
Калашникова Е.А.
Российский государственный аграрный университет-МСХА имени К.А.
Тимирязева, Москва, Россия, e-mail: mia41291@mail.ru
Получение
гаплоидных растений белокачанной капусты (Brassica oleracea L.) в условиях in vitro
Важным
направлением в современной селекции является создание улучшенных и
принципиально новых генотипов сельскохозяйственных растений, обладающих
единичной, групповой или комплексной устойчивостью к биотическим и абиотическим
стрессовым факторам среды при сохранении и повышении их продуктивности и
качества. Рациональное сочетание методов классической селекции с
биотехнологическими методами позволяет решать поставленные задачи в более
короткий срок.
Метод культуры изолированных пыльников и
микроспор (андрогенез) – один из перспективных способов получения гаплоидных
растений. Подбор оптимальных условий культивирования, обеспечивающих
дифференцировку эмбриоидов из репродуктивных органов (микроспоры и семяпочки) и
сравнение этого процесса с процессом формирования соматических и зиготических
зародышей является предметом биохимических и морфологических исследований, и
целью опытов по изучению молекулярных механизмов, специфичных для эмбриогенеза.
Андрогенез зависит от ряда
взаимосвязанных факторов (генетических, физиологических, факторов внешней среды
(минеральномого и гормонального состава питательной среды), условий
культивирования), каждый из которых оказывает свое влияние на морфогенетические
процессы при культивировании изолированных пыльников и микроспор in vitro. Результаты
исследований ряда авторов показали, что до сих пор эмбриогенез в культуре пыльников in
vitro различных видов Brassica
происходит спонтанно и имеет низкую частоту выхода гаплоидных растений (1-4%), более
того предлагаемые технологии трудно воспроизводимы и недостаточно изучены на
каждом этапе андрогенеза. Помимо этого, технология получения
растений-регенерантов различных видов
Brassica из изолированных семяпочек (процесс гиногенеза) из известной
литературы не отработана.
Целью наших исследований являлась разработка
регламента получения растений-регенерантов белокочанной капусты (B. oleracea L.) из
репродуктивных органов путем прямого эмбриогенеза.
Работу проводили
на линиях и гибридах F1 представителей рода Brassica- белокочанной капусте (B. oleracea L.): гибрид F1 Юбилей, линии ЭТ1 и АМФ 3Л. Растения – доноры выращивали в теплице на Селекционной станции им. Н.Н. Тимофеева РГАУ-МСХА имени К.А. Тимирязева в течение
года. Объектом исследования служили
изолированные бутоны, микроспоры, завязи и семяпочки.
В работе
использовали питательные среды по прописи Мурасиге и Скуга с добавлением фитогормонов. В качестве веществ с
цитокининовой активностью использовали препарат Дропп, БАП, кинетин, 2ip в концентрациях 0,01 - 2,0 мг/л, в качестве
веществ ауксинового типа – 2,4-Д, НУК, ИУК в концентрациях 0,5 – 1,5 мг/л. рН среды 5,5-5,8.
В работе нами были оптимизированы этапы получения
растений-регенерантов путем прямого эмбриогенеза из микроспор изолированных пыльников
(Рис.1). Предложена схема комплексной
предобработки соцветий пониженными (+4-60С в течение 2-х суток) и повышенными (+320С в течение 1-х
суток) температурами
в сочетании с обработкой соцветий нитратом серебра (40 мг/л), обеспечивающая индукцию
прямого эмбриогенеза. 




а б
в
г
Рис. 1. Этапы получения растений-регенерантов путем прямого
эмбриогенеза из микроспор изолированных пыльников (гибрид F1 Юбилей): а – образование адвентивных побегов, б –
рост побегов и формирование корневой системы, в – растения перед высадкой в
почву, г – растения-регенеранты в почве,
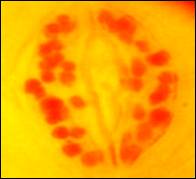
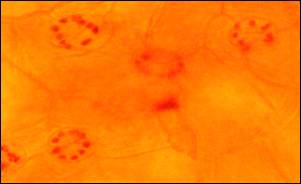
Цитологический анализ
растений-регенерантов проводили путем подсчета количества хлоропластов в
замыкающих клетках устьиц. Установлено,
что количество хлоропластов в клетках устьиц гаплоидного растения составило от
10 до 15 шт., в то время как у исходных донорных растений их было от 35 до 45
шт. (Рис. 2).
а б
Рис. 2. Хлоропласты в замыкающих клетках устьиц: а– исходные растения белокочанной капусты, б -растения-регенеранты (F1 Юбилей)
Установлено положительное влияние торфо-дернового субстрата (в соотношении 1:1) на адаптацию растений-регенерантов
белокочанной капусты к условиям in vivo (Рис. 3).


а б
Рис.3. Адаптация растений-регенерантов: а- линии ЭТ1; б- F1 Юбилей
Литература
1.
Гурецка, К. Получение гомозиготных линий капусты белокочанной (Brassica
oleracea L, var capitata L.) через культуру пыльников - Скерневицы, 1998. – 71с.
2.
Жамбакин, К.Ж.
Гаплоидная биотехнология растений. - Алматы, 2004.-186 с.
3.
Калашникова Е.А.
Клеточная инженерия растений: Курс лекций. М.: Изд-во РГАУ – МСХА имени К.А. Тимирязева, 2009. – 94 с.
4.
Калашникова Е.А.,Чунг
Май Дык Теоретические и практические аспекты получения гаплоидных и
дигаплоидных растений in vitro различных видов Brassica-LAP: LAMBERT Academic Publishing, 2012,
126 с.
5. Чистякова В.Н. Гаплоиды неполных пшенично-пырейных амфидиплоидов, мягкой пшеницы и ячменя: получение и использование. М. МАКС Пресс, 2000. - 355 с.