Аспирант Рой И. Ю., к.т.н. Решетняк Л. Р., д.б.н.
Здоровенко Г. М., д.б.н. Ставская С. С.
Институт коллоидной химии и химии воды имени А. В. Думанского, Украина
ИССЛЕДОВАНИЕ ОСОБЕННОСТЕЙ НАТИВНЫХ
БИОПЛЕНОК С АКТИВНОГО УГЛЯ ПРИ ЭКСПЛУАТАЦИИ ПРОМЫШЛЕННЫХ АДСОРБЦИОННЫХ ФИЛЬТРОВ
Введение.
Одной из характерных особенностей
большинства бактерий является их способность к адгезии, поэтому большинство
природных популяций бактерий существует в прикрепленном состоянии в виде
биопленок («biofilms»),
в естественных и искуственно
созданных субстратах [1, 2]. Согласно
современным представлениям биопленка – это непрерывный мультислой бактериальных
клеток, прикрепленных к поверхности раздела фаз и друг к другу и заключенных в
биополимерный матрикс [3, 4]. В такой форме бактерии способны обмениваться
сигналами и проявлять координированную активность, подобно тканям
многоклеточных организмов.
Для клеток, интегрированных в биопленку,
характерна плотная упаковка, которая способствует межклеточному общению и
передаче межклеточных сигнаов, а также более успешному процессу естественного
обмена генетической информацией [5].
Развитие биопленочных сообществ является
одной из основных стратегий выживания бактерий в занимаемой ими экологической
нише.
Бактерии
в прикрепленном состоянии, будучи интегрированными в биопленку, обладают
повышенной устойчивостью к воздействию биоцидов и других стрессовых факторов
внешней среды. В таких сообществах более активно проходят многие биохимические
процессы, например утилизация некоторых субстатов [6,7].
Микроорганизмы образуют биопленку на любых
биотических и абиотических поверхностях, что создает большие проблемы в
медицинской практике и в различных областях хозяйственной деятельности. Как
теперь установлено, биопленки являются одним из патогенетических факторов
формирования хронических инфекционных процессов [8].
Бактериальная биопленка образуется в
результате сложных координированных взаимодействий микроорганизмов с
поверхностью. Последовательность событий в наиболее общем виде выглядит
следующим образом: начальное прикрепление к поверхности, образование монослоя,
движение по поверхности с образованием микроколоний, созревание биопленки и
формирование трехмерной структуры. В образовании биопленки принимают участие
поверхносные структуры бактерий: выросты клеточной стенки, жгутики и пили,
которые обеспечивают подвижность. Мутанты, дефектные по подвижности, неспособны
к формированию биопленки [9, 10].
Адгезия является ключевым моментом в
образовании биопленки, а адгезины способствуют преодолению сил отталкивания при
взаимодействии одноименно заряженных поверхностей, участвуя в переходе к
необратимой стадии формирования биопленки. Различают две основные группы
бактериальных адгезинов: те, что связанны с органеллами – фимбриями (F- пили; curli-пили; пили I, IV типа и др.),
и адгезивные факторы нефимбриальной природы (экзполисахариды и другие
соединения). Вкачестве адгезинов рассматривают также также S-слои клеточной стенки, состоящие из упорядоченно
расположенных протеиновых или гликопротеиновых субъедениц [11]. Наиболее полно
исследованы фимбрии или пили у грамотрецательных бактерий (Escherichia coli, Pseudomonas aeruginosa,
Klebsiella pneumonia и др.) В
последнее время пили, участвующие в биопленкообразовании, обнаружены у
грамположительных бактерий [12]. Исследование и выявление пилей, используемых
бактериями при прикреплении к поверхностям различной природы, важно для выбора
антиадгезивных средств борьбы с биопленками на ранних этапах их формирования.
Однако молекулярные механизмы взаимодействия бактерий с поверностями различной
природы мало исследованы.
Дальнейшее формирование бипленки
сопровождается образованием экзополимерного матрикса – продукта
жизнедеятельности самих клеток. Матрикс является основным структурным
компонентом биолленки [13]. Экзополисахариды (ЭПС) составляют значительную
часть матрикса – 85% массы биопленки, 15% - бактерии. Эти экзополимеры образуют
капсулу, слизистые слои, а также могут освобождаться во внешнюю среду,
отделяясь от клеточной поверхности. Наряду с ЭПС в составе матрикса обнаружены
белки, нуклеиновые кислоты, липополисахариды, лектины, минералы, необходимые
для формирования полноценной биопленки. Функции матрикса разнообразны. Помимо
каркасной, основной функцией матрикса является протекторная. ЭПС сорбирует
металлы и минералы, растворенные органические вещества, концентрирует
питательные вещества, ферменты и ростовые факторы. ЭПС матрикса играет важную
роль, фиксируя и закрепляя бактерии в тех экологических нишах, где существует
угроза смыва. Также установлена роль матрикса в образовании полимикробных
биопленок [14].
Благодаря всем этим
свойствам биопленки обладают чрезвычайной устойчивостью, и удаление их с
каких-либо поверхностей является сложной задачей.
Весьма популярными
устройствами для промышленной очистки
воды и доочистки водопроводной воды
являются сорбционные фильтры на основе АУ. Но, как показывает опыт эксплуатации угольных фильтров, даже при высоких
показателях чистоты воды, поступающей на угольные фильтры, и периодических
термических санациях (промывка водой при 95оС в течение 2,5 ч)
невозможно приостановить развитие микрофлоры на длительное время. В период санационной
обработки фильтра горячей водой, уцелевшие единичные планктонные клетки
начинают процесс активного формирования микроколоний и создания биопленки, как
способа выживания в экстремальных условиях. Уже через 3-е суток после
термической обработки на поверхности гранул АУ наблюдается формирование биопленки.
Для разработки методов управления
свойствами биопленки необходимы сведения о биологических особенностях бактерий,
развивающихся в процессе подготовки воды по высоте загрузки фильтра. Следовательно изучение видового состава контаминантов и
понимание фундаментальных экологических механизмов формирования и
функционирования биопленок позволит разработать методы борьбы
с ними.
Таким образом, целью настоящей работы было
исследование нативных биопленок из АУ
промышленных фильтров пивоваренного производства, используемых для доочистки
водопроводной воды, а также изучение
морфолого-культуральных и физиолого-боихимических особенностей бактерий
- образователей биопленки для оценки и прогнозирования рациональных условий
работы фильтра.
Методика
эксперимента. В работе изучали
свойства бактерий, выделенных нами при исследовании двух марок гранулированного
активного угля (ГАУ) - Silcarbon K-835; Filtrasorb 400, отобранных на различных
глубинах (с поверхности угольного фильтра, на глубине 0,5 м и 1м) фильтрующего слоя загрузки угольного фильтра. На
фильтр поступала вода из городского водопровода, соответствующая нормативным
требованиям к питьевой воде, прошедшая доочистку на песчаных фильтрах и
содержащая 0,2-0,4мг/дм3 активного остаточного хлора. Образцы для анализа отобраны через трое суток эксплуатации фильтра
после проведения температурной санации.
Чистые культуры бактерий выделяли по
методу Голда [15].
При изучении морфолого-культуральных
свойств бактерий на плотных питательных средах описали их следующие признаки:
форму колонии, их размер (диаметр), поверхность, профиль, блеск и прозрачность,
цвет колонии, край, структуру и консистенцию [16].
Способность выделенных бактериальных
изолятов образовывать пелликулу, определяли методом посева в жидкую питательную
среду [13,17].
Окраску по Граму проводили двумя методами:
классическим [16]
и
экспресс – методом по Крегенсену [18].
Физиолого-биохимические особенности
микроорганизмов определяли по следующим признакам: окисление и ферментация
глюкозы, разжижение желатина,
способности к образованию сероводорода, индола, аммиака, наличие каталазной,
оксидазной, нитратредуктазной активности, подвижность [15,16,19,20].
Результаты и
обсуждения
Задачей нашего исследования было изучение
микрофлоры смывов с проб АУ фильтра. Анализ макроморфологических свойств
микробных колоний показал небольшую их вариабельность. При микроскопировании
все микроорганизмы были отнесены к бактериям. Из колоний, которые обладали
такими культуральными свойствами, что указывают на способность образовывать
биопленку, были выделены чистые культуры бактерий.
Согласно [13], существует корреляция между морфологией колонии и
способностью клеток синтезировать ЭПС. Так, с помощью сканирующей и
просвечивающей электронной микроскопии было показано, что микробные клетки,
образующие при выращивании на плотных питательных средах хорошо
структурированные (морщинистые, шероховатые, складчатые) колонии, окружены
экстрацеллюлярным матриксом, тогда как культуры, мутантные по гену, отвечающему
за синтез ЭПС, образуют гладкие и плоские колонии [7,17]. Таким образом, при
описании макроморфологических признаков выделенных бактериальных культур в
первую очередь обращали внимание на поверхность колонии, ее профиль и
консистенцию.
Согласно этому подходу, из индивидуальных
колоний, выявленных в смывах с проб АУ, отобранных на глубине 0; 0,5 и 1 м,
были выделены три количественно преобладающие для данных слоев АУ культуры
(изоляты), обозначаемые в дальнейшем соответственно №1, №2 и №3. Морфолого-культуральные
свойства данных изолятов приведены в табл. 1.
Таблица 1. Морфолого - культуральные
особенности микроорганизмов, выделенных из смывов исследуемого угля.
|
Морфолого- культуральные особенности выделенных колоний |
Номер образца |
||
|
№1 |
№2 |
№3 |
|
|
Форма колонии |
круглая |
неправильная |
сложная |
|
Размер колонии,мм |
d =1-2 мм |
d =3-4 мм |
d =8-12 мм |
|
Поверхность колонии |
морщинистая |
морщинистая |
шороховато- морщинистая по краю гладкая |
|
Профиль колонии |
изогнутый |
бугристый |
бугристый |
|
Блеск, прозрачность |
тусклая |
тусклая |
тусклая по
краям блестящая |
|
Цвет колонии |
безцветная |
белая |
безцветная |
|
Край колонии |
волнистый |
волнистый |
волнистый |
|
Структура колонии |
мелкозернистая |
мелкозернистая |
неоднородная: мелкозернистая по
краю однородная |
|
Консистенция колонии |
плотная |
плотная |
колония
мягкая, легко
снимается с агара
по краю слизистая |
Примечание. Среда культивирования – МПА,
время культивирования – 48 ч ,
температура культивирования – 37 оС.
Как видно из табл. 1, все изоляты имели морщинистую или
шероховато-морщинистую поверхность колоний, т. е. находились в R-форме, что
характерно для бактерий – активных образователей биопленки [13, 17]. Колонии
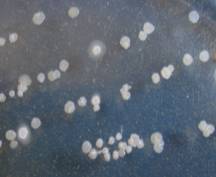
культуры №1, выделенной с поверхности угольного фильтра, были мелкие – 1-2 мм в
диаметре и имели округлую форму (рис. 1, А). У изолята № 2, наиболее типичного
для смывов с АУ с глубины 0,5 м, колонии отличались неправильной формой и более
крупными размерами (3-4 мм) рис. 1, Б). Из смывов с проб, отобранных из
фильтра на глубине 1 м, как наиболее характерная была выделена культура,
которая не встречалась в смывах с верхлежащих слоев АУ.
Колонии изолята № 3 были довольно крупные – 8-12 мм в диаметре,
неправильной формы и мягкой консистенции, по краю тягучие и слизистые, что
также является важным признаком способности микроорганизмов к образованию
биопленки (рис. 1, В ) [13].
|
А |
Б |
В |
Рис 1. Особенности роста бактериальных изолятов на плотной
питательной среде.
![]()
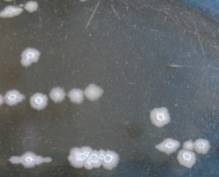
При исследовании роста микроорганизмов в жидкой
питательной среде показано, что при культивировании в МПБ в течении 24-48 часов
все три выделенные бактериальные культуры образовывали на границе раздела фаз
«жидкость-воздух» плотную морщинистую пленку, так называемую пелликулу [7]
(рис 2). Формирование данными изолятами
толстых, хорошо структурированных пелликул может рассматриваться как
макроморфологический признак, свидетельствующий об их способности образовывать
биопленку [7, 13, 17].
![]()



Рис. 2. Особенности
роста выделенных бактериальных изолятов в жидкой питательной среде.
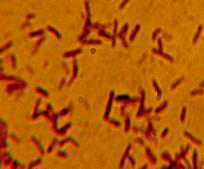
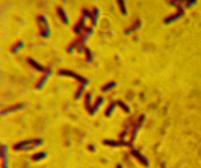
Характерной особенностью бактерий, широко используемой для первичной
идентификации выделенных неизвестных бактерий является их способность
окрашиваться по Граму. Все исследованные культуры относятся к грамположительным бактериям, форма клеток
– палочковидная (рис 3).
|
А |
Б |
В |
Рис. 3 Окраска по Граму выделенных типов
микроорганизмов.
Использование
экспресс-метода (по Крегенсену) для определения грам-типа исследуемых нами
образцов бактерий подтвердило данные, полученные классическим способом окраски
по Граму.
При микроскопии клеток (рис.3) видны бактерии с неокрашенной зоной в
центральной части клетки, что свидетельствует о наличие эндоспор [16], таким
образом, тип спорообразования – бациллярный, расположение споры в клетке –
центральное.
Физиолого – биохимические особенности
выделеных микроорганизмов представлены в табл. 2.
Таблица 2. Физиолого – биохимические
особенности выделеных микроорганизмов.
|
Биохимический тест |
Тип выделенных колоний |
||
|
№1 |
№2 |
№3 |
|
|
Окисление/ферментация глюкозы |
+/- |
+/- |
+/- |
|
Гидролиз желатины |
+ |
+ |
+ |
|
Образование сероводорода |
- |
- |
- |
|
Образование аммиака |
- |
- |
- |
|
Образование индола |
- |
- |
- |
|
Нитратредуктазная активность (способность восстанавливать NO3 до NO2 ) |
- |
- |
- |
|
Каталазная активность |
+ |
+ |
+ |
|
Оксидазная активность |
+ |
+ |
+ |
|
Подвижность |
+ |
+ |
+ |
Наличие у исследуемых культур каталазной и
оксидазной активности указывает на принадлежность их к аэробным бактериям, что подтверждается также отсутствием
способности к анаэробной ферментации глюкозы.
Положительная реакция установлена также при гидролизе желатина. Тесты на
образование аммиака, сероводорода, индола во всех образцах дали отрицательный
результат.
Таким образом, отличающиеся по морфологии
колоний, три выделенные нами наиболее распространенные в загрузке угольного
фильтра бактериальные культуры, которые могут играть важную роль в образовании
и функционировании биопленки на фильтре в процессах доочистки воды, были
идентичны по изученным
физиолого-биохимическим свойствам.
Выводы.
При исследовании нативных биопленок,
образовавшихся на загрузке угольного
фильтра системы подготовки технологической воды в производстве пива и безалкогольных
напитков, были выделены три чистые культуры бактерий. Изучение их по ряду
физиолого-биохимических и морфолого-культуральных признаков дает основание
отнести исследуемые изоляты бактерий к представителям рода Bacillus. Исследование макроморфологических свойств выделенных
бактерий, а именно: особенностей образования колоний на плотных питательных
средах и способности к образованию пелликулы при росте в жидких питательных
средах, может свидетельствовать об их принадлежности к активным образователям биопленок на гранулированном АУ.
СПИСОК
ЛИТЕРАТУРЫ
1. Flemming, H.-C. 1993. Biofilms and
environmental protection. Water Sci.Technol. 27: 1-10
2. Hamilton W. A. Biofilms: microbial
interactions and metabolic activity // Ecology of Microbial Communities. – Cambridge: Cambridge Univ. Press, 1987.
– P. 361-385.
3. Miller M. B., Bassler B. L. Quorum
sensing in bacteria // Ann. Rev. Microbiol. 2001. V.55. P. 165 – 199.
4. Гинцбург А.
Л., Ильина Т. С., Романова Ю. М. «Quorum sensing» или социальное поведение
бактерий // Журн. Микробиол. эпидемиол. 2003. № 5. С. 86 – 93.
5. Романова Ю.
М., Смирнова Т. А., Андреев А. Л., Ильина Т. С., Диденко Л.В., Гинцбург А. Л Образование
биопленки – пример «социального поведения» бактерий // Микробиология. 2006. Т. 75. № 4. С. 481 – 485.
6. Dunne W. M. // Clinical Microbiology
Rev. – 2002. – 15, N. 2. – P.155 –
166.
7. Friedman L., Kolter R. // Mol. Microbiol. – 2004. – 51.
– P. 675 – 690.
8. Costerton J.
W., Stewart P. S., Greenberg E. P. Bacterial biofilm: a common cause of persistent
infection // Science. 1999. V. 284. P. 318 – 322.
9. O’Toole G. A., Kolter R. Flagellar and twitching
motility are necessary for Pseudomonas
aeruginosa biofilm development // Mol. Microbiol.
1998. V. 30. P.
295 – 304.
10. Романова Ю. М., Алексеева Н. В., Смирнова Т. А., Андреев А. Л., Диденко Л.В., Гинцбург А. Л Способность
к формированию биопленки в искусственных системах у различных штаммов Salmonella typhimurium //
Журн. микробиол. эпидемиол. иммунол. 2006. № 4. С. 38 – 42.
11. Северина Л. О.
Бактериальные S-слои // Микробиология. 1995. Т. 64. №
6. С. 725 – 733.
12. Budzig J.
M., Sheewind O. Pili prove pertinent to enterococcal endocarditis // J.
Clin. Invest. 2006. V. 116. P. 2582 – 2584.
13. Branda S.
S., Vic. A., Friedman L., Kolter R.
Biofilm: the matrix revisted // Trends in Micribio. 2005.
V. 13. № 1. P.
21 – 25.
14. Смирнова Т. А.,
Диденко Л. В., Азизбекян Р. Р., Романова Ю. М. Структурно – функциональная
характеристика бактериальных биопленок // Микробиология. 2010. Т. 79. № 4. С.
435 – 446.
15. Поздеев О. К.
Медицинская микробиология / Под ред. В. И. Покровского. – 2-е изд., испр. – М.:
ГЭОТАР-МЕД, 2004. – С. 267 – 268.
16. Руководство к практическим занятиям по микробиологии:
Практ. Пособие / Под ред. Н. С. Егорова.
– 2-е изд. - М.: Изд-во Моск. ун-та 1983. – С. 125 – 129;
67 - 68.
17. Ali A.,
Rashid М. H., Karaolis D.K. R. // Appl. Environ. Microbiol. – 2002. – 68, N. 11. – P. 5773 – 5778.
18. Гудзь С., Гнатуш С., Білінська І. Практикум з мікробіології.
Частина перша. Навчальний посібник. – Львів: Видавничий центр ЛНУ імені Івана Франка,
2003. – 80 с
19. Hung R., Leifson E. // Bacteriol.
1953. V. 66. N. 1. P. 24.
20. Kovach N. // Nature. –
1956. – V. 178. – N. 4535. – P. 703.