Биологические науки/ 8. Физиология
человека и животных
М.н.с. Сущенко І. Г. 2,
студ. Лещук О. М.1, к.б.н. Дрегваль І. В.1, к.б.н.
Руденко А. І.2
1Днепропетровский національний університет ім. О. Гончара
2ДУ «Інститут гастроентерології АМН України»
Зміни показників реогепатограми при збільшенні
концентрації NO в організмі щурів
Захворювання печінки є одним з найтяжчих, широко
розповсюджених та складно діагнозтованих захворювань органів черевної
порожнини. Йому супроводжує цілий ряд ускладнень, а клінічний плин та результат
захворювання часто важко передбачувані. Відомо, що при важких панкреатитах,
насамперед, страждають мікроциркуляція та системна гемодинаміка [1].
Актуальною залишається проблема прогнозування потенційної ваги гострого
панкреатиту, можливості передбачити деструктивний процес на початку
захворювання. Наявність періоду оборотних патологічних змін (ішемії та
некробіозу) у плині гострого деструктивного панкреатиту дозволяє проводити
терапію захворювання [2]. Однією з можливостей поліпшити стан при розвитку захворювання є збільшення
мікроциркуляції крові у печінці.
Відомо, що мікрогемодинаміки печінки може змінюватись в
залежності від концентрації оксиду азоту (NO) у
організмі. Оксиду азоту є одним з найбільш
важливих біологічних медіаторів, який залучений
у безліч фізіологічних і патофізіологічних
процесів. Характерною рисою NO є його здатність швидко усередині клітини
активувати одні ензими та інгібувати інші. NO є вазодилятаторною молекулою, що
змінює тонус у деяких судинних басейнах, включаючи легені та системний кровообіг [5]. Ця молекула утворюється переважно з індуцибельної (iNOS) та ендотеліальної (еNOS) синтаз оксиду азоту у печінці [6],
зокрема оксид азоту, що синтезується за
допомогою еNOS є важливим фактором у
регуляції нормального печінкового
кровотока. L-аргінін є субстратом для всіх ізоформ NOS при продукуванні
NO [7]. Визначено, що оксид азоту ефективно діє у відношенні полегшення портальної гіпертензії при цирозах печінки. Він також бере участь у
реалізації багатьох важливих фізіологічних функцій, таких як вазоділатація,
регуляція тонусу гладких м'язів, нейротрансмісія та ін.
Вплив оксиду азоту вивчається за допомогою
експериментальних моделей захворювань печінки. На сьогодні існують моделі
патології, які індукуються нітро-L-аргініном, тетрахлоркарбоном (ССl4),
етанолом (C2H5OH), нітропурсидом натрію. Викликаючи певні
розлади у системі внутрішньо печінкового кровообігу, виникає проблема
реєстрації зміни кровонаповнення. Сучасні методи функціональної діагностики
розладів периферичного кровообігу мають різні діагностичні можливості [8, 9].
Для визначення змін кровообігу у
експериментальних умовах нами вперше запропоновано реографічний метод
реєстрації показників мікроциркуляції крові
у печінці в експериментальних умовах на дрібних лабораторних тваринах.
Метод реографії дозволяє оцінювати загальні та регіональні зміни у судинній системи печінці,
викликані функціональними судинними розладами. В
основі методу реографії лежить принцип реєстрації мінливих у часі коливань
електричного опору судинної системи печінки. Ці зміни електричного опору
відбуваються в ритмі скорочення серця й залежать від змін обсягу крові, що
протікає у судинній системи печінці. Дана методика безпечна, проста у
використанні та аналізі отриманих результатів, досить інформативна, а також
може при необхідності застосовуватися багаторазово на одній тварині. Повторні дослідження на тій самій тварині
дозволяють порівнювати різні реографічні криві та тим самим спостерігати за
динамікою гемодинамічних змін.
Тому завдання нашого дослідження полягало у визначенні
основних характеристик мікроциркуляторного русла при розвитку панкреатиту
різного ступеня важкості за допомогою методу реографії, а також його
прогностичне значення. Зважаючи на те, що гемодинамічне порушення з'являються
вже на ранніх стадіях захворювання [3] і характеризується зростанням загального
судинного опору, зниженням обсягу циркулюючої крові, зменшенням центрального
венозного тиску та порушеннями мікроциркуляції, нами були проведені дослідження
зі зниження загального опору судин та, як наслідок, підвищення мікроциркуляції
крові у печінці.
Дослідження
проведено на 10 білих щурах-самцях масою 180-240 г у віці 6 місяців. Всі
тварини утримувались в однакових умовах. Тварини були поділені на три групи.
Першу групу склали інтактні тварини, другу групу склали тварини, яким
одноразово вводили нітропрусид натрію (1,5 мг/кг маси тіла), до третьої групи
увійшли тварини після тривалого (6-деннного) введення нітропрусиду натрію (1,5
мг/кг маси тіла).
За 16-20 годин до експериментів тварин піддавали харчовій
депривації при вільному доступі до води.
Реєстрацію реограми печінки щурів здійснювали за
допомогою поліграфа П6Ч-01 з комп’ютерною обробкою результатів дослідження.
Запис РГГ проводиться
синхронно разом з ЕКГ. Аналіз отриманих реограм проводиться шляхом вивчення
форм вершини основної хвилі, кількості та
виразності додаткових зубців, а також кількісного визначення часу поширення
пульсової хвилі, кута нахилу анакроти, тривалості висхідної та спадної частин
пульсової хвилі, їх співвідношення та амплітуди.
Статистична обробка
отриманих даних проводилась за допомогою комп’ютерних програм з використанням
методів варіаційної статистики [4]. При цьому для показника визначали середнє
арифметичне значення (M) та похибку середнього (m). Досліджувані співвідношення
вважали достовірними при р< 0,05.
На першому етапі
наших досліджень було встановлено, що при однократному введені нітропрусиду
натрію на РГГ спостерігалось збільшення артеріального припливу (показник (а)
табл. 1.), ймовірно є наслідком зниження пульсових коливань артеріальних
печінкових судин, що підтверджується даними реограмами (час максимального
підйому на реограмі). Артеріальне наповнення печінки у фазі швидкого та
повільного наповнення печінкової артерії та її гілок проходило на 10 та 20 хв
відповідно.
Найбільший ефект зменшення портального кровотоку у наших
дослідженнях спостерігалось через 15 хв після введення препарату нітропрусид
натрію до організму щурів рис. 1. Незважаючи на зменшення портального кровотока
печінки в 2,5 разу у порівнянні з контролем (показник (а/b) табл. 1.),
збільшення тривалості діастолічної хвилі (показник (b) табл. 1.) на реограмі,
ймовірно, свідчить про застої у портальній системі печінки, що може бути
розвитком тенденції до збільшення загального судинного опору печінки.
Таблиця 1
Показники
реогепатограм щурів до та після введення нітропрусиду натрію
|
|
Показники реограми |
контроль |
5 хвилина |
10 хвилина |
15 хвилина |
20 хвилина |
25 хвилина |
30 хвилина |
|
|
|
Qx |
М |
0,021 |
0,015 |
0,019 |
0,019 |
0,020 |
0,020 |
0,024 |
|
|
m |
0,002 |
0,002 |
0,002 |
0,002 |
0,002 |
0,002 |
0,006 |
|
|
|
а |
М |
0,153 |
0,195 |
0,192 |
0,185 |
0,201 |
0,201 |
0,191 |
|
|
m |
0,003 |
0,009 |
0,008 |
0,005 |
0,010 |
0,010 |
0,005 |
|
|
|
b |
М |
0,323 |
0,326 |
0,329 |
0,330 |
0,350 |
0,350 |
0,313 |
|
|
m |
0,009 |
0,013 |
0,011 |
0,015 |
0,015 |
0,010 |
0,014 |
|
|
|
a/b |
М |
0,490 |
0,645 |
0,614 |
1,290 |
0,598 |
0,680 |
0,639 |
|
|
m |
0,015 |
0,038 |
0,024 |
0,064 |
0,026 |
0,029 |
0,063 |
|
|
|
α/β |
М |
1,540 |
1,189 |
0,576 |
0,554 |
1,151 |
1,272 |
1,097 |
|
|
m |
0,067 |
0,080 |
0,015 |
0,018 |
0,064 |
0,097 |
0,071 |
|
|
|
h1/h2 |
М |
0,565 |
0,567 |
0,576 |
0,554 |
0,531 |
0,521 |
0,561 |
|
|
m |
0,017 |
0,026 |
0,015 |
0,018 |
0,021 |
0,023 |
0,027 |
|
|
|
RI |
М |
1,496 |
1,453 |
1,431 |
1,431 |
1,414 |
1,396 |
1,335 |
|
|
m |
0,024 |
0,023 |
0,018 |
0,018 |
0,017 |
0,014 |
0,023 |
|
|
|
АЧП |
М |
3,020 |
2,958 |
2,784 |
2,927 |
2,717 |
2,946 |
2,768 |
|
|
m |
0,079 |
0,161 |
0,112 |
0,134 |
0,148 |
0,131 |
0,112 |
|
Введення
нітропрусиду натрію призводить до зменшення тонусу великих судин та збільшення
наповнення печінки. За даними наших досліджень на судини середнього та малого
радіусу введення нітропрусиду натрію впливає не так істотно, як на судини
великого радіусу. Відтік крові від печінки дещо зменшується, у відношенні до
притоку. Це викликає збільшення печінки у розмірі та деякому застою крові.
Найбільший ефект спостерігається на 15 хв після введення нітропрусиду натрію,
потім дія нітропрусиду натрію дещо слабшає, але до контрольних величин діаметр
великих судин не доходить. Ефект зменшення тонусу судин можна простежити за
показником (α/β) табл. 1.
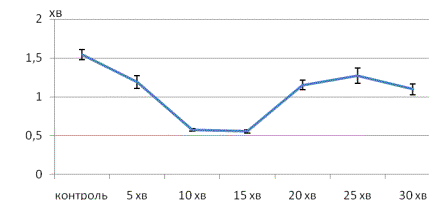
Рис. 1. Динаміка відношення тривалості систолічної та діастолічної хвилі
реограми печінки щурів після введення нітропрусиду натрію.
Показники: на вісі
абсцис час замірів тривалості постсистолічної хвилі реогепатограм щурів; на
вісі ординат час тривалості постсистолічної хвилі реогепатограм щурів після
введення нітропрусиду натрію.
На 25 хв нами
спостерігалось збільшення відтоку крові, що ймовірно є впливом нітропрусиду
натрію на судини середнього та малого діаметра, але вже на 30 хв цей вплив
зменшується.
За даними наших
експериментів після введення нітропрусиду натрію спостерігалось збільшення
тривалості постсистолічної хвилі з піком на 20 хв експерименту, це можливо
пов’язано з повільним впливом нітропрусиду натрію на судини середнього та
малого діаметру, що відображається у мікроциркуляції крові в печінці. Тільки
через 30 хв після введення нітропрусиду натрію у наших експериментах
спостерігалось збільшення мікрогемодинаміки печінки, що можливо пов’язано з
одного боку з дією препарату на судини середнього та малого діаметру, з іншого
боку припинення дії нітропрусиду натрію на судини великого діаметру (показник
(α/β) табл.1).
Враховуючи будову
печінки щура, яка складається з п’яти часток до яких кров потрапляє двома
шляхами: від ворітної вени та печінкової артерії. Після введення препарату амплітуда
систолічної хвилі дещо знижується, але тривалість підвищується у зв’язку з
наповненням багаточисельних гілок та синусів печінки. Збільшення тривалості
кровонаповнення судин печінки також пов’язано зі зниженням тиску крові, як
одного з факторів дії нітропрусиду натрію на судинну систему щурів.
Величина об’ємного
кровотоку після введення нітропрусиду натрію дещо зменшується з піком на 20 хв,
але протягом досліджень мала більш-менш стабільні коливання табл. 1.
Аналізуючи дані
наших досліджень було встановлено, що підвищення вмісту оксиду азоту в
організмі тварин призводить до більш вираженого зменшення тонусу у великих
судинах печінки. На судини середнього та малого діаметру підвищений вміст
оксиду азоту менш виражений та нетривалий. Підвищений вміст оксиду азоту може
викликати деякий застій крові у печінці, що ймовірно є одним з факторів
розвитку панкреатиту.
Використовуючи
показники реогепатограм можна визначити порушення гемодинаміки печінки та розпал
хвороби – ішемії печінки, зниження опору артеріальних судин печінки, зменшення
відтоку портальної крові на тлі гіпердинамічного типу кровообігу (збільшення
серцевого викиду та зниження загального периферичного опору).
Література
1. Винник Ю.
С. Кровотечение и
трансфузиология / Ю. С. Винник, Л. В. Кочетова, Е. А. Карлова,
С. С. Дунаевская. http://www.ukazka.ru/product-book198733.html– М.: Феникс,
Издательские проекты.– 2007. – 160 с.
2. Кондратенко П.Г. Острый панкреатит /
П.Г. Кондратенко, А.А. Васильев, М.В. Конькова: Донецк, – 2008. – 352 с.
3. Foitzik T.
The course of bacterial infection of the pancreas and its relation to disease
severity in rodent model of acute necrotizing pancreatitis / T. Foitzik, K.
Mithofer, M. J. Ferraro [et al.] //
Ann Surg. – 1999. – Vol. 220. – P. 193-198.
4. Петри
А. Наглядная статистика в медицине / А. Петри, К. Сэбин. – М.: ГЕОТАР –
МЕД. – 2003. – 143 с.
5. Mittal M. K. Nitric oxide modulates hepatic vascular tone in
normal rat liver / M. K. Mittal,
T. K. Gupta, F. Y. Lee, C.C. Sieber,
R. J. Groszmann. // Am. J.
Physiol. – 1994. – 267. – P.G416 – G422.
6. Marletta M. A. Catalysis by nitric oxide synthase / M. A. Marletta, A. R. Hurshman, K. M. Rusche. // Curr. Opin. Chem. Diol. – 1998. – 2– P. – 656 – 663.
7. Bruckdorfer R.
The basics about nitric oxide / R. Bruckdorfer. // Mol. Aspects Med. – 2005.– 26. – P. – 3 – 31.
8. Hwang T. L. The changes of hepatic sinusoidal microcirculation
and effects of nitric oxide synthase inhibitor during sepsis / T. L. Hwang, M. L. Han. //
Hepatogastroenterology. – 2003.– № 50 (49). – P. 213–216.
9.
Tawadrous
M. N. Persistence of impaired hepatic microcirculation after non arterialized
liver transplantation in the rat / M. N. Tawadrous,
A. Zimmermann, X. Y. Zhang. // Microcirculation. – 2002. – 9 (5). – P. 363–375.