Курмышева А.Ю., Забенькина Е.О.
Московский
государственный машиностроительный университет,
Россия
Исследование
адсорбции молибдат-ионов на оксиде алюминия, Al2O3.
Вместе с ростом промышленных достижений растет и необходимость извлекать ионы тяжелых металлов из сточных вод. Ионы тяжелых металлов, растворенные в воде, считаются опасными загрязнителями ввиду их токсичности даже при малых концентрациях. Очистка сточных вод от загрязнений ионами тяжелых металлов в последние годы стало важной экологической задачей.
Существует ряд традиционных методов очистки водоемов от примесей металлов: это ионный обмен, электрохимическое восстановление, обратный осмос, химическое осаждение, мембранная фильтрация. Перечисленные методы трудоемки в своем исполнении, и очистные установки, необходимые для их использования, имеют высокую стоимость.
Исследование процесса адсорбции показало, что извлечение ионов тяжелых металлов из водных растворов адсорбцией - хорошая альтернатива известным дорогостоящим и сложным методам.
Благодаря высокой температуре плавления, высокой прочности при повышенных температурах, хорошей коррозионной стойкости и высокой теплопроводности, молибден с каждым годом все шире используется в различных промышленных процессах. Однако, молибден является токсичным веществом. Потенциальную опасность здоровью человека молибден проявляет при концентрации в воде начиная со значения 0.25 мг/л.
С ростом задействованного в промышленности молибдена растет и угроза засорения этим металлом сточных вод, почв возле промышленных центров. Поэтому проблема очистки сточных вод от этих металлов очень актуальна в наши дни.
В настоящей работе проведено исследование адсорбции ионов молибдена на оксиде алюминия, как на наиболее распространенном адсорбенте, применяющемся во многих отраслях химической промышленности.
1. Экспериментальная часть.
1.1 Объекты. В качестве объектов исследования были использованы порошкообразные препараты оксида алюминия, Al2O3, соль молибдата натрия, NaMoO4∙2H2O. С целью идентификации, образцы порошка оксида алюминия были исследованы методами термоанализа, РФА, ИК-спектроскопии. Полученные данные по характеристикам оксида соответствуют литературным [1].
Образцы молибдата натрия, переведенные в водные растворы с различным значением рН были проанализированы спектрально, методом комбинационного рассеяния. Полученный спектр так же соответствует литературным данным[2].
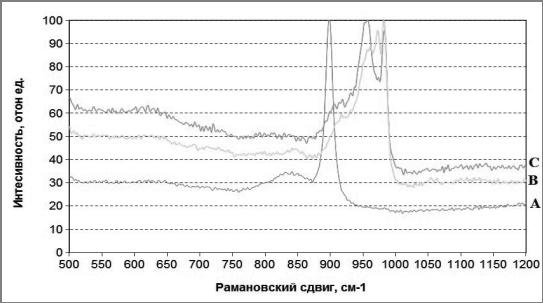
Рис.1 Спектр А, В, С соответствуют Рамановскому спектру раствора 100 ммоль/л молибдена при рН 4, рН 6, рН 8 соответственно.
Согласно рассмотренным литературным данным [2], при расшифровке максимумов пиков поглощения, в растворе молибдена с рН превышающем рН 6 доминируют ионы МоО42-; в диапазоне рН от 5 до 2 преобладает частица НМоО41-; при рН меньше чем рН 3 — Н2МоО4. Это, в свою очередь, соответствует результатам, полученным в [3]:
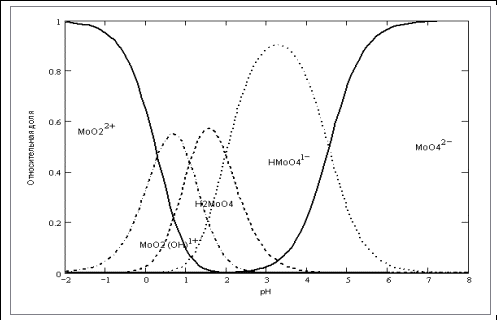
Рис.2 Зависимость распределения относительной доли различных ионов Мо (VI) от рН.
1.2 Адсорбция. Серию экспериментов по адсорбции проводили путем перемешивания навески оксида алюминия массой в 1 г в растворах молибдата натрия с концентрациями 0.01, 0.005, 0.003 моль/л и при рН от 2 до 10. рН среду создавали небольшими добавлениями в раствор соли соляной кислоты, HCl и щелочи, NaOH. Конечную концентрацию молибдена определяли фотоколориметрически роданидным методом, описанным у Марченко З. и Бальцежак М. [4]. Длина волны составляла 460 нм.
Величину адсорбции определяли по разнице начальной и конечной концентрации: Г = Сисх-Скон.
2. Результаты и обсуждение.
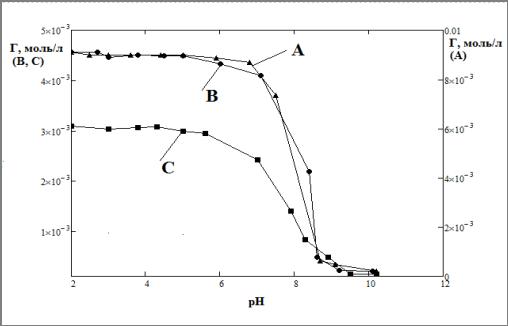
В результате проведенной серии экспериментов по влиянию рН раствора на адсорбцию молибдат-ионов на оксиде алюминия, нами были получены результаты, представленные на рисунке 3.
Рис. 3 Зависимость величины адсорбции от рН при разных концентрациях молибдена в растворе: А — 0.01 моль/л; В — 0.003 моль/л; С — 0.005 моль/л.
Процентное соотношение адсорбированного вещества (относительная адсорбция, Г, %) вычислялось по формуле:
![]() ,
(1)
,
(1)
Результаты представлены на рисунке 4.
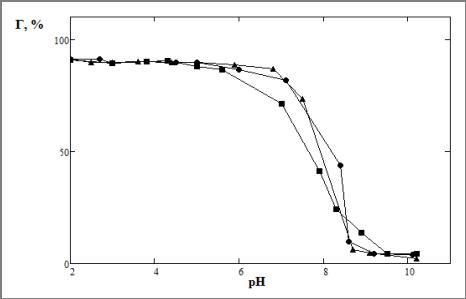
Рис.4 Зависимость относительной адсорбции, Г, %, от рН раствора. ![]() - раствор молибдена 0.01 моль/л;
- раствор молибдена 0.01 моль/л; ![]() - 0.005 моль/л;
- 0.005 моль/л; ![]() - 0.003 моль/л.
- 0.003 моль/л.
Из данных рисунков 3 — 4 следует, что с увеличением рН раствора количество адсорбированных анионов молибдена уменьшается, что свидетельствует о том, что анионы адсорбируются на положительно заряженной поверхности оксида алюминия.
Величина
константы адсорбционного равновесия вычислена по формуле:
![]() , (2)
, (2)
где K – константа
адсорбционного равновесия;
n – тангенс угла наклона логарифмической прямой к оси абсцисс.
Найденная
константа адсорбционного равновесия численно совпадает с логарифмом константы
диссоциации реакции HMoO4- = H++MoO42- , рК, равной
4.21 [5]. Это, главным образом, говорит о том, что анион в растворе
подвергается гидролизу и образует гидратированные формы, проявляющие высокую
адсорбционную способность на положительно заряженной поверхности оксида
алюминия, что доказывает протекание процесса гидролиза, предшествующего началу
адсорбции.
Выводы.
1.
Полученные экспериментальные
результаты исследования растворов молибдата методом Рамановской спектроскопии
имеют сходимость (по пикам) с литературными данными [2] существования наиболее
стабильных форм молибдат-ионов в определенном диапазоне рН;
2.
Из п.1 выводов можно заключить,
что существует возможность прогнозирования того, какая форма молибдат-ионов
будет сорбироваться на поверхности оксида алюминия в той или иной области рН.
3.
Так как молибдат-ионы наиболее
эффективно адсорбируются в кислой области (на положительно-заряженной
поверхности оксида алюминия), то можно предположить, что основные сорбируемые
формы молибдат-ионов - это HMoO4-,
MoO4-.
Литература:
1.
Самсонов Г.В. Физико-химические свойства окислов. М.:
Металлургия, 1969г. 455с.
2.
Sabine Goldberg, Cliff T. Johnston, Donald L. Suarez1
and Scott M. Lesch Mechanism of Molybdenum Adsorption on Soils and Soil Minerals Evaluated Using Vibrational Spectroscopy and Surface Complexation Modeling / Mark O. Barnett and Douglas B. Kent (editors) / Adsorption of metals by Geomedia 2008, chapter 9.
3.
Горичев И.Г., Артамонова И.В., Лайнер Ю.А., Изотов А.Д., Казиев Г.З., Петроченков В.А. Электрохимическое и коррозионное поведение молибдена и его оксидов в растворах электролитов: монография/ И.Г. Горичев, И.В. Артамонова, Ю.А. Лайнер, А.Д. Изотов, Г.З. Казиев, В.А. Петроченков - 1-е изд. – М.: МГТУ «МАМИ», 2010.- 120 с.
4.
Марченко З., Бальцежак М. Методы спектрофотометрии в УФ и видимой областях в неорганическом анализе. / Марченко З., Бальцежак М. Методы спектрофотометрии в УФ и видимой областях в неорганическом анализе. - М.: БИНОМ. Лаборатория знаний, 2007.– 711с.
5.
D.D. Perrin Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution / D.D. Perrin Pergaman Press, New York, 1982.
Работа
выполнена при
финансовой поддержке
государственной программы«Научные
и научно-педагогические
кадры инновационной
России на
2009–2013годы»
(контракты №14.740.11.1095,
16.740.11.0679) и
аналитической ведомственной
целевой программы
(шифр заявки
№ 3.5258.2011).
Измерения спектров КРС проведили в Центре коллективного пользования
РХТУ
им.Д.И.Менделеева