д.м.н. Кручинина М.В., к.м.н. Громов А.А.,
Баум В.А., Рабко А.В.
ФГБУ «НИИ терапии» СО РАМН, Новосибирск, Россия
к.х.н. Кручинин В.Н., к.т.н. Рыхлицкий
С.В., к.ф.-м.н. Володин В.А.
Институт физики полупроводников им. А.В.
Ржанова СО РАН, Новосибирск
д.ф.-м.н. Князев Б.А., Герасимов В.В.
Институт ядерной физики им. Г. И. Будкера СО РАН,
Новосибирск, Россия
Новосибирский государственный университет,
Новосибирск, Россия
к.ф.-м.н. Анцыгин В.Д.
Институт автоматики и электрометрии СО
РАН, Новосибирск, Россия
Особенности параметров
эритроцитов, гемостаза при цереброваскулярной патологии – новые возможности оптических
методов
Введение. В последние годы интенсивно разрабатывается учение о
роли систем гемореологии и гемостаза в развитии ишемических нарушений мозгового
кровообращения. Принципиальное
значение имеет разработка концепции гетерогенности ишемического инсульта,
которая обозначила исключительное многообразие его причин и механизмов, определяющих
чрезвычайный полиморфизм структурных поражений головного мозга и клинических
проявлений [1]. В связи с этим
особую актуальность имеет разработка новых подходов в диагностике наблюдаемых
нарушений, причем на ранних стадиях. Оптические методы занимают особое место в
биомедицинских исследованиях, благодаря высокой чувствительности,
неразрушающему и невозмущающему характеру воздействия на исследуемый объект [2].
Кроме того, известно, что цереброваскулярная
патология сопровождается не только изменениями гемореологического статуса, но и
выраженными сдвигами в составе и структуре компонентов сыворотки крови, что, в
свою очередь, приводит к изменению ее оптических характеристик [3].
Цель. Оценить возможности оптических методов исследования сыворотки крови,
эритроцитов у пациентов с цереброваскулярной патологией для использования их в
диагностике.
Материалы и методы. Обследованы: 10 мужчин (45-67 лет) без признаков цереброваскулярной патологии и заболеваний внутренних органов (группа сравнения) и 12 мужчин (43-70 лет), перенесших ишемический инсульт (на фоне артериальной гипертензии II-III ст., дислипидемий IIa, IIb типа), преимущественно в подостром и резидуальном периодах. У обследуемых проведены исследования: системы гемостаза - стандартными методами, электрических и вязкоупругих параметров эритроцитов - методом диэлектрофореза в частотном диапазоне 5.104-106Гц, взвесей эритроцитов -методом терагерцовой спектроскопии; тонких пленок, полученных из сыворотки крови центрифугированием, - методом спектральной эллипсометрии и спектроскопии комбинационного рассеяния света (Raman).
Результаты
исследования.
При сравнении
наблюдаемых групп выявлены достоверные различия в параметрах эритроцитов: у
больных, перенесших инсульт, обобщенные
показатели жесткости, вязкости, электропроводности мембран эритроцитов, относительной
поляризуемости, индексов агрегации, деструкции достоверно выше, а среднего
диаметра клетки, поляризуемости на всех частотах, емкости мембран клеток,
скорости движения к электродам, дипольного момента, амплитуды деформации
эритроцитов под действием неоднородного переменного электрического поля (НПЭП) -
ниже по сравнению с группой контроля (p<0,0001-0,05). У больных, перенесших инсульт,
обнаружено достоверное увеличение скорости лейкоцитарно-тромбоцитарной
агрегации (ЛТА) по сравнению с аналогичными показателями здоровых лиц (7,92+0,07
против 11,5+0,3 с, р<0,001), выявлена обратная корреляция этого показателя
со сроками инсульта (r=-0,45, p<0,05). Агрегация тромбоцитов (ГАТ 10-2)
оказалась достоверно ниже по сравнению с группой контроля (16,2+0,3
против 13,4+0,4 с, р<0,01), снижение скорости агрегации тромбоцитов
при инсульте, вероятно, обусловлено потреблением активных клеток в кровотоке [4]. О повреждении эндотелия свидетельствует повышение
уровня фактора Виллебранда в плазме крови больных инсультом (128,6+11,7
против 92,2+7,4 %, р<0,05) [5].
Исследование
взвесей эритроцитов методом терагерцовой спектроскопии выявило низкие уровни
амплитудного пропускания излучения на всех частотах диапазона у пациентов с
цереброваскулярной патологией в отличие от группы контроля (p<0,001-0,05) (см. рис. 1). Причем,
спектроскопические показатели коррелировали со склонностью эритроцитов к
образованию агрегатов (r=0,61, p<0,01), преобладанием деформированных форм
эритроцитов (r=0,74, p<0,05),
сниженным дипольным моментом клеток (r=-0,52, p<0,03), амплитудой деформации эритроцитов под
действием НПЭП (r=-0,43, p<0,02) и емкостью мембран эритроцитов (r=0,45, p<0,05).
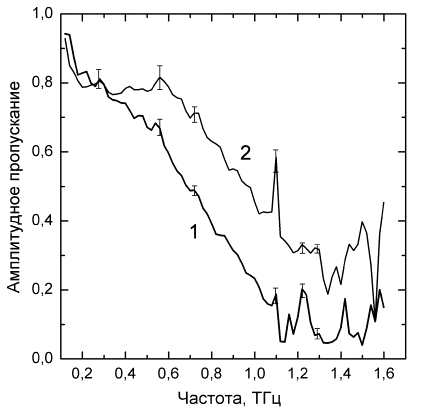
Рис. 1. Зависимость амплитуды пропускания ТГц
излучения слоями взвесей эритроцитов пациентов, перенесших инсульт (1) и лиц группы
контроля (2).
Исследование
эллипсометрических показателей тонких пленок, полученных из сывороток крови
пациентов с инсультами, выявило достоверное снижение показателя преломления
(1,48+0,003 против 1,52+0,004, p<0,0001) в сочетании с увеличением толщины пленки
(175,4+3,4 против 159,3+2,7, p<0,001), степенью ее неоднородности (3,48+0,9
против 1,4+0,7 p<0,05) по
сравнению с группой контроля. Толщина пленки оказалась зависящей не только от
ряда биохимических параметров (уровня общего холестерина r=0,62, p<0,002; триглицеридов
r=0,53, p<0,03;
общего белка r=0,44, p<0,03), но и от факторов свертывания крови (ГАТ 106
- r=0,749, p<0,033; ЛТА
- r=0,758, p<0,029;
уровня фибриногена r=0,61, p<0,02). В то же время на равномерность пленок также
оказывали влияние факторы гемостаза (ЛТА физиологическая - r=0,792, p<0,019;
уровень аутокоагуляционного теста, А2 - r=-0,729, p<0,05;
антитромбина III - r=-0,852, p<0,007).
Показатель преломления в большей степени зависел от уровня трансаминаз,
показателей пуринового обмена.
При исследовании жидких
сывороток крови пациентов, перенесших инсульты, и лиц группы сравнения существенные
изменения наблюдались и в спектрах комбинационного рассеяния света, где
регистрируются интенсивности пиков, связанных с колебаниями отдельных молекулярных
фрагментов, определяющих вторичную структуру белков.
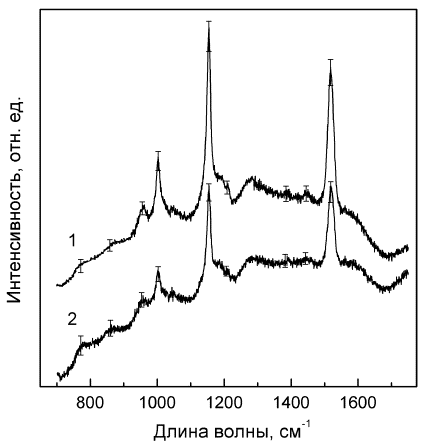
Рис.2 Спектры комбинационного рассеяния света жидких
сывороток крови пациентов, перенесших инсульт (1) и лиц группы контроля (2).
В спектрах
комбинационного рассеяния света образцов жидких сывороток крови в области
750-1750 см-1 наблюдается ряд характерных пиков поглощения при 780, 860
см-1, интенсивности которых оказались достоверно ниже, а при 1001,
1154, 1210, 1391 и 1518 см-1 - достоверно выше у пациентов с
цереброваскулярной патологией по сравнению с контролем (р<0,001-0,05).
При детальном анализе
выяснилось, что величины интенсивности пиков в Раман-спектрах зависели как от
биохимических параметров сыворотки крови, так и от показателей системы гемостаза.
Соответственно, выявились корреляции и с данными эллипсометрии тонких пленок из
сывороток крови. Поскольку между компонентами сыворотки крови и мембранами
эритроцитов происходит постоянный обмен составляющими [6], то неудивительными
оказались и связи пиков Раман-спектров с вязкоупругими параметрами эритроцитов.
Площади пиков при 780, 860
см-1 оказались связанными с биохимическими показателями функции
печени – уровнем общего (r=0,775, p<0,041 для 860 см-1) и прямого билирубина (r=0,847, p<0,016 для
860 см-1), АСТ (r=-0,897, p<0,006 для 780 см-1), ЩФ (r=-0,875, p<0,01
для 780 см-1), а также – с уровнем мочевой кислоты (r=-0,786, p<0,036
для 780 см-1). Кроме того, на интенсивность данных пиков оказывали
влияние факторы гемостаза – уровень антитромбина III (r=-0,731, p<0,04
для 780 см-1; r=0,85, p<0,007 для 860 см-1), протеина С (r=-0,779, p<0,05
для 780 см-1; r=0,934, p<0,006 для 860 см-1), волчаночного
антикоагулянта (r=-0,767, p<0,026 для 860 см-1). По данным Downes A., Elfick A. [7] на
интенсивность пика при 780 см-1 оказывали влияние уровень ДНК,
выраженность колебаний групп О-Р-О протеинов; в отношении же пика при 860 см-1
значимым оказался уровень аминокислоты тирозин [8, 9]. С ней связывают стресс-протекторную, психостимулирующую, регулирующую функции
щитовидной железы и надпочечников, она является предшественником нейромедиаторов.
Снижение интенсивности пика при 860 см-1 у пациентов с
инсультами в определенной степени отражает снижение уровня данной аминокислоты,
ряда протеинов, чем, вероятно, определяются нарушения ряда когнитивных функций
при цереброваскулярной патологии.
Показатель преломления
тонких пленок, полученных из исследуемых сывороток, прямо и с высокой силой
коррелировал с высотой пика при 860 см-1 (r=0,714, p<0,0001) и обратно был связан со степенью
однородности полученных пленок (r=-0,643, p<0,05). Толщина пленок при этом обратно зависела от
высоты пика при 780 см-1 (r=-0,196, p<0,042).
Выявлено, что высота пика при 780 см-1 оказалась связанной с уровнем
гемолиза эритроцитов на низких частотах (r=-0,717, p<0,045),
вместе с тем, она оказывала влияние на положение равновесной частоты (r=0,683, p<0,05).
Степень же деформации эритроцитов на частоте 0,5 МГц прямо и с высокой силой коррелировала
с площадью пика при 860 см-1 (r=0,755, p<0,031).
Интенсивности пиков при 1001, 1154, 1210,
1391 и 1518 см-1 оказались в большей степени связанными с
показателями липидного спектра сыворотки крови, измененного пуринового обмена,
нарушенной функцией почек. Это согласуется с результатами исследования Tatarkovic M. еt al. [8] о
влиянии на выраженность данных пиков уровней липидов атеросклеротических
бляшек, каратиноидов [9]. Так, площадь пика при 1001 см-1 прямо
коррелировала с уровнем холестерина ЛПНП (r=0,971, p<0,001),
мочевой кислоты (r=0,865, p<0,012) и обратно – с уровнем ХС ЛПВП (r=-0,908, p<0,005).
По данным Rodia-Osornio L.N. et al. [9] на интенсивность данного пика оказывает
существенное влияние дисбаланс фениналанина. Известно, что избыточное
накопление этой незаменимой аминокислоты и ее метаболитов оказывает
неблагоприятное воздействие на нервную систему. Площадь пика при 1210 см-1
продемонстрировала связь с уровнем
креатинина (r=0,811, p<0,027), отклонение пика при 1391 см-1
оказалось зависящим от уровня общего холестерина (r=-0,841, p<0,036),
а его высота – от уровня триглицеридов (r=0,771, p<0,05).
Интересными оказались связи вышеуказанных пиков с показателями гемостаза. Уровни
протромбинового индекса, растворимых комплексов фибрин-мономера прямо
коррелировали с площадью пика при 1391 см-1 (r=0,75, p<0,05; r=0,777, p<0,04,
соответственно). Уровень антитромбина III
оказывал влияние на высоту пика при 1154 см-1(r=0,778, p<0,023), а
уровни протеина С и волчаночного антикоагулянта влияли на площадь пика при 1518
см-1 (r=0,943, p<0,005; r=0,707, p<0,05, соответственно). Возможно, полученные
результаты объясняются данными Rodia-Osornio L.N. et al. [9], Camerlingo C. Et al. [10],
которые установили зависимость интенсивности пиков при 1154, 1518 см-1 от
количества С-С связей, выраженности деформационных колебаний С-ОН, уровней amid I молекул
протеинов.
Из эллипсометрических
показателей выявились обратные взаимосвязи показателя преломления с площадью
пика при 1154 см-1 (r=-0,642, p<0,05) и прямые – с толщиной пленки (r=0,747, p<0,0001). С
неоднородностью пленок коррелировало отклонение пика при 1210 см-1 (r=0,69, p<0,05).
Обнаружены связи ряда вязкоупругих показателей эритроцитов с интенсивностями
пиков Раман-спектров. Так, амплитуда деформации клеток оказалась обратно
связанной с интенсивностью пика при 1001 см-1 (r=-0,722, p<0,043),
а обобщенная жесткость эритроцитов продемонстрировала с ней прямую связь (r=0,766, p<0,027). Обобщенная
вязкость коррелировала с интенсивностями пиков при 1001 см-1 (r=0,922, p<0,001) и
при 1210 см-1 (r=0,85, p<0,007). Уровень гемолиза на высоких частотах был
связан с интенсивностью пика 1518 см-1 (r=0,807, p<0,015 для 1
МГц; r=0,818, p<0,013 для
0,5 МГц).
Таким
образом, выявленные новые возможности оптических методов исследования крови, ее
отдельных компонентов являются весьма перспективными в диагностике цереброваскулярной
патологии, гетерогенности ишемического инсульта, возможно, в будущем, и на
ранних стадиях. Они проливают свет на взаимосвязи, взаимозависимости компонентов
гемореологии между собой при развитии острых нарушений мозгового кровообращения.
Работа
выполнена при частичной финансовой поддержке Минобрнауки РФ (ГК №02.740.11.0556),
гранта РФФИ 11-02-12171-офи-м при использовании оборудования ЦКП СЦСТИ
в рамках ГК № 16.552.11.7044 и при использовании оборудования
научно-образовательного комплекса НГУ «Наносистемы и современные материалы».
Литература:
1.
Суслина З.А., Танашян
М.М., Ионова В.Г. Ишемический инсульт: кровь, сосудистая стенка,
антитромботическая терапия. - М.: Медицинская книга. - 2005. - 248 с.
2.
Arwin H. Ellipsometry on thin
organic layers of biological interest: characterization and applications //
Thin Solid Films. - 2000. - V.377-378. - P.48-56.
3.
Nogueira G.V., L. Silveira, A., Jr., Martin A. et al. Raman spectroscopy
study of atherosclerosis in human carotid artery // J. of Biomed. Optics. –
2005. - V.10. - No.3. - P.031117(1-7).
4.
Coull B.,
Williams L., Goldstein L. et al. Anticoagulants and antiplatelet agents in
acute ischemic stroke // Stroke. – 2002. – V.33. – No.7. – P.1934-1942.
5.
Drexler H.,
Hornig B. Endothelial dysfunction in human disease // J. of molecular and
cellular cardiology. – 1999. – V.31. – No.1. – P.51-60.
6.
Новицкий В.В., Рязанцева
Н.В., Степовая Е.А. Физиология и патофизиология эритроцита. - Томск: Из-во ТГУ.
- 2004. - 202 с.
7.
Downes A., Elfick A. Raman spectroscopy and related techniques in biomedicine
// Sensors. – 2010. – N.10. – P.1871-1889.
8.
Tatarkovic M., Fisar Z., Raboch J., Jirak R., Setnicka V. Can
chiroptical spectroscopy be used for the analysis of blood plasma? //
Chirality. – 2012. – V.6. – P.459-467.
9.
Rocha-Osornio L.N., Pichardo-Molina J.L., Barbosa-Garcia O. et al. Chemamometric
techniques on the analysis of Raman spectra of serum blood samples of breast
cancer patients // Proc. of SPIE. – 2008. – V.6864. – P.16(1-7).
10. Camerlingo C.,
Zenone F., Perna G. et al. An investigation on micro-raman spectra and wavelet
data analysis for pemphigus vulgaris follow-up monitoring // Sensors. – 2008. –
V.8. – P.3656-3664.