Ахметова Б.С., Колбай И.С., Шайхымбекова Р., Нуралина
М.Е.
ДГП «Центральная лаборатория биоконтроля, сертификации
и предклинических испытаний» РГП «Центр биологических исследований» КН МОН РК
Влияние фитопрепарата «Экдифит» на
биохимические
показатели и клеточный состав крови при
регрессии
экспериментального гипертиреоза.
Многие заболевания и патологические
состояния сопровождаются эндогенной недостаточностью, характеризующейся резким
уменьшением в организме пластических и энергетических веществ, что приводит к
значительным нарушениям метаболического статуса. Из них гипертиреозы
представляют серьезную проблему, использующиеся в мировой практике методы
терапии этого заболевания имеют ряд недостатков, связанных с побочными эффектами лекарственных препаратов, их
невысокой эффективностью, частыми
рецидивами после лечения и т.д. Гипертиреозы, связанные с ускоренным
метаболизмом и глубокими нарушениями белкового, липидного и углеводного
обменов, часто сопровождаются истощением организма в пластическом материале и
значительной потерей веса [1,2].
Благоприятный фармакологический
эффект анаболических средств обусловлен
стимулирующим влиянием их на биосинтез нуклеиновых кислот, белка, липидов и
других макромолекул организма. Разработанный
в АО «НПЦ «Фитохимия» (г.Караганда) анаболический препарат «Экдифит»
(ЭФ), представляет собой
экдистероидсодержащую фракцию известного
с древности лекарственного растения
серпуха венценосная (Serratulla coronata L.).
В связи с этим, возможность коррекции
патологических процессов, связанных с развитием гипертиреозов, с помощью
анаболического препарата «Экдифит», представляет несомненный научный и
практический интерес. Цель настоящего
исследования заключалась в изучении влияния фитопрепарата «Экдифит» на
спонтанную регрессию экспериментального гипертиреоза в сравнении и в
сочетании с известным тиреостатиком
мерказолилом (МЗ).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на
50 белых лабораторных крысах
обоего пола массой тела 120-180 г,
содержавшихся на стандартном виварийном рационе. Для моделирования гипертиреоза 40 крысам ежедневно вводили перорально через зонд
водный раствор калия йодида в дозе 0,06 г/кг.
Остальные 10 крыс составили
контрольную группу. Через 40 дней после
начала эксперимента животных разделили на группы, которым в течение последующих
40 дней также per os через зонд
ежедневно давали препараты в
соответствии со способами терапии, представленными в таблице 1.
Таблица
1 –
Способы терапии гипертиреоза
|
серия |
n |
препарат |
Доза |
|
Контроль |
11 |
35% этиловый спирт |
0,5мл |
|
Гипертиреоз (ГТ) |
5 |
35% этиловый спирт |
0,5мл |
|
Гипертиреоз+мерказолил
(ГТ + МЗ) |
5 |
мерказолил,
водный раствор |
1 мг/100г |
|
Гипертиреоз+экдифит
(ГТ + ЭФ) |
3 |
экдифит,
в 35% спиртовом растворе |
10 мг/100г |
|
Гипертиреоз+мерказолил+экдифит
(ГТ + МЗ + ЭФ) |
7 |
мерказолил,
водный раствор; экдифит, в 35% спиртовом растворе |
1 мг/100г 10 мг/100г |
По истечении срока терапии у животных в
остром опыте под тиопенталовым наркозом (4 мг/100 г) брали кровь на анализы. Активность аспартатаминотрансферазы (АсАТ), аланинамино-трансферазы (АлАТ),
щелочной фосфатазы (ЩФ) в плазме крови определяли с использованием коммерческих
тест-наборов фирмы Biosystems (Испания) на
полуавтоматическом биохимическом анализаторе Screen Master (Италия).
Цитологический анализ крови поводили на автоматическом гематологическом
анализаторе Sismex КХ-21 (Япония). Полученные данные обрабатывали
статистически с использованием непарного критерия Фишера-Стьюдента и
непараметрического Mann-Whitney U теста и изменения считали достоверными при
р≤0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ
ОБСУЖДЕНИЕ
В проведенных экспериментах показано, что развитие
гипертиреоза сопровождается снижением
содержания АсАТ на 12%, АлАТ - на 5% и
ЩФ - на 12% (рисунок).
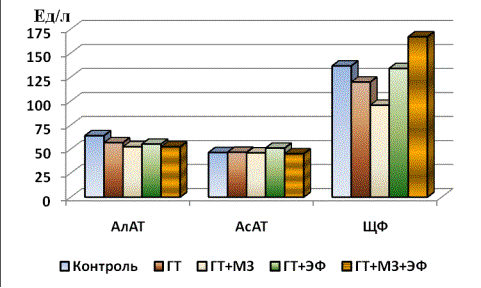
ГТ –
гипертиреоз; МЗ – мерказолил; ЭФ – экдифит
Рисунок – Изменение акивности (Ед/л) ферментов АсАТ,
АлАТ и ЩФ в сыворотке крови у крыс разных групп
Терапия МЗ, ЭФ и их сочетанное применение приводили к
росту концентрации как АсАТ, так и
АлАТ, хотя полного восстановления первоначального уровня указанных ферментов в
крови не наблюдалось. При этом ЭФ более
эффективен в случае с обоими ферментами,
чем МЗ и сочетанная терапия.
Концентрация ЩФ, продолжавшая
снижаться при воздействии МЗ ( на 10% по сравнению с контролем), повышалась под
влиянием терапии ЭФ (на 15% сравнению
группой ГТ+МЗ) и еще более (на 35%) - при сочетанном использовании ЭФ и
МЗ. При этом содержание ЩФ в крови было
ближе к контролю в группе с ЭФ.
Полученные нами данные по снижению активности ЩФ при гипертироидизме, являющейся маркером костного роста,
согласуются с литературными данными о влиянии повышенной деятельности
щитовидной железы на костный метаболизм
[3-7]. В таблице 2 представлены данные цитологического анализа крови у экспериментальных
животных.
Таблица 2 - Цитологические
параметры крови у крыс разных групп при гипертиреозе и изучаемых способах
терапии
|
Показатель |
Группа |
||||
|
Контроль |
ГТ |
ГТ+МЗ |
ГТ+ЭФ |
ГТ+МЗ+ЭФ
|
|
|
Эритроциты, ×109/л |
7,115 (6,78-8,15) |
7,39 (6,32-7,86) |
7,78 (6,63-8,95) |
7,3 (7,2-8,1) |
7,49а (7,2-8,14) |
|
Гемоглобин, г/дл |
12,05 (11-13,4) |
12,1 (11,2-12,9) |
12,6 (11,1-13,3) |
12,3 (11,2-12,5) |
12,2 (11,9-12,8) |
|
Лейкоциты, ×106/л |
7,2 (3,8-11,7) |
7,2 (3,9-8,6) |
9 (5,5-11,6) |
7,9 (5,2-8,9) |
6 (4,8-7,4) |
|
Лимфоциты, ×106/л |
4,4 (2,4-8,9) |
4,5 (2,3-5,7) |
5,2 (3,7-7,1) |
5,4 (3,1-5,8) |
4 (3-5,6) |
|
Средние клетки, ×106/л |
0,4 (0,2-0,6) |
0,4 (0,25-0,9) |
0,5 (0,2-0,9) |
0,6 (0,2-0,8) |
0,45 (0,3-0,6) |
|
Нейтрофилы, ×106/л |
1,6 (1,1-2,8) |
2 (1,35-3,2) |
1,9 (1,6-5,7) |
1,9 (1,7-2,5) |
2 (1,3-2,4) |
|
Тромбоциты, ×106/л |
926,5 (670-1292) |
696a (541-790) |
804b (735-902) |
835a,b (707-850) |
748 (607-994) |
|
СОТ, fl |
6,4 (6,2-6,6) |
6,8a (6,4-7,5) |
6,2 (6,1-6,8) |
6,9a,c 6,9 |
6,3b (6-7,2) |
|
УБТ, % |
4,3 (3,7-5,7) |
6,8a (3,9-10,1) |
3,8b (3,7-5,7) |
6,6a,c (6,1-7,6) |
4,2 (3,4-8,8) |
|
Примечания:
Значения – медианы ( в скобках указаны пределы) а - р<0,05 по сравнению с нормой; b - р< 0,05 по сравнению с группой ГТ; с - р<
0,05 по сравнению с группой ГТ+МЗ |
|||||
Обнаружена
тенденция к увеличению содержания эритроцитов и гемоглобина при гипертиреозе,
которое усиливается под влиянием МЗ (на 10% сравнению с нормой), но не ЭФ.
Повышение уровня эритроцитов на 5,3% при сочетанном применении
препаратов оказалось достоверным.
Лейкоцитарный состав крови не
изменился при гипертиреозе по сравнению с контролем, но оказался чувствительным
к терапии: содержание лейкоцитов повысилось на 25% при лечении МЗ, приближалось
к контрольным значениям в случае с ЭФ, а при сочетанной терапии снизилось на
10% (Таблица 2). Аналогичная тенденция была замечена также при анализе уровня
лимфоцитов и суммарной фракции
базофилов, эозинофилов и моноцитов (средние клетки), нейтрофилы же накапливались у всех изучавшихся групп
животных по сравнению с нормой. Факт
накопления в крови лейкоцитов под влиянием МЗ, указывающий на неизвестной
этиологии воспалительный процесс, предполагает побочный эффект МЗ. Отметим, что
подобный эффект не обнаружен в случае с ЭФ.
Интересные данные получены нами по содержанию тромбоцитов (Таблица 2).
Гипертиреоз вызвал снижение количества
в крови тромбоцитов на 33% (р<0,05), увеличение среднего объема
тромбоцитов (СОТ) на 6,3% (р<0,05) и
уровня больших тромбоцитов (УБТ) на 50% (р=0,05). МЗ, ЭФ и сочетанная терапия
достоверно (р<0,05) повышали содержание тромбоцитов по сравнению с
гипертиреозом. Отмечено также достоверное (р<0,05) увеличение СОТ под
влиянием ЭФ, но не МЗ и сочетанной терапии и, напротив, ЭФ не оказывал
заметного влияния на УБТ, а МЗ и
сочетанная терапия приближали этот показатель к норме. Соответственно зафиксирована
достоверная (р<0,05) разница в
указанном показателе между исследованными группами.
Подводя
итоги анализа клеточного состава крови можно констатировать, что, имея
одинаковую с МЗ эффективность в отношении нормализации тромбоцитарного статуса крови
и большую – в отношении содержания эритроцитов, ЭФ имеет преимущество,
заключающееся в отсутствии побочного эффекта, наблюдаемого при действии МЗ и
связанного с повышением уровня лейкоцитов в крови.
ЛИТЕРАТУРА
1 Репродуктивная эндокринология /
Под ред. С.С.К.Йена, Р.Б.Джаффе. Т.1.- М.: Медицина, 1998. – 702 с.
2 Тапбергенов С.О., Тапбергенов
Т.С. Адрено-тиреоидная система. Биоэнергетика клетки и механизмы адаптации к
стрессу. – Семипалатинск: Изд-во СГМА, 1998. – 158 с.
3. Taelman P., Kaufman J., Janssens X. е.а. Reduced forearm
bone mineral content and biochemical evidence of increased bone turnover in
women with euthyroid goitre treated with thyroid hormone // Clin. Endocrinol. – 1990. – V.33. – Р.107-117.
4. Knudsen N.,
Faber J., Sierbek-Nielsen A. е.а. Thyroid hormone treatment aiming at reduced, but not
suppressed, serum thyroid-stimulating hormone levels in nontoxic goitre:
effects on bone metabolism amongst premenopausal women // Journal of Internal Medicine. – 1998.
– V.243. – Р.149-154.
5. Faber J,
Galløe A. Changes in bone mass during prolonged sub-clinical
hyperthyroidism due to thyroxine treatment: a meta-analysis // Eur. J. Endocrinol. – 1994. – V.130. – Р.350-356.
6. Marcocci C.,
Golia F., Bruno-Bossio G. е.а. Carefully monitored levothyroxine suppressive
therapy is not associated with bone loss in premenopausal women // J. Clin. Endrocrinol. Metab. – 1994.
– V.78. – Р.818-820.
7. Fujiyama K.,
Kiriyama T., Ito M. e.a. Suppressive
doses of thyroxine do not accelerate age-related bone loss in late
post-menopausal women // Thyroid. – 1995.
– V.5. – Р.13–17.