Хімія та хімічні технології
Фундаментальні
проблеми створення
нових матеріалів і
технологій
Михайловська
Т.М., Волощук Ю.В.
Чернівецький
національний університет імені Юрія Федьковича
Кінетичні
Закономірності перетворення кальцій гідрокарбонату в карбонат за присутності
гідроген пероксиду
Специфічна
особливість сучасного етапу розвитку – стрімке збагачення природних, оборотних
і стічних вод сполуками різної будови та складності. Реагуючи
з розчиненим у воді киснем ці сполуки можуть піддаватися рідиннофазному
окисненню з утворенням оксигенвмісних похідних. Як наслідок, зменшується
концентрація кисню в природних водах, а також з’являються пероксидні сполуки
[1].
Природні води широко
використовуються в різних галузях промисловості часто без попередньої водопідготовки.
Звичайно, пероксидні сполуки будуть впливати на інтенсивність процесів
солеосадження, корозії на металевих поверхнях технологічного обладнання. Тому
метою дослідження було встановлення впливу на прикладі найпростішого з
пероксидів – гідроген пероксиду – на перетворення кальцій гідрокарбонату в
карбонат (модель хімічних перетворень, яка передує відкладенням солей
твердості).
Експеримент проводився в
умовах механічного перемішування реакційної суміші. За кінетичними кривими
зменшення іонів кальцію в процесі перетворення кальцій гідрокарбонату в
карбонат проводився розрахунок кінетичних параметрів.
Кінетичні
криві мають типовий S-подібний характер (рис.1).
Індукційний період на початку зв’язаний із тим, що кальцій карбонат хоч і
погано, але все ж розчинний у воді, тому і не фіксується зменшення іонів
кальцію. Крім того, для перебігу стаціонарної кристалізації потрібна відповідна
кількість центрів кристалізації, яких в готовому вигляді в системі немає і, на
утворення яких потрібний час. В стаціонарному режимі кінетика зменшення іонів
кальцію добре описується рівнянням 2-го порядку [2]:
1/[Са2+]t
– 1/[Са2+]0 = kеф.·t
Кінетичні закономірності процесу в усьому діапазоні умов дослідження
залишалися незмінними. Лімітуюча стадія процесу – масопередача реакційного
карбон (IV) оксиду з рідкої фази в
газову.
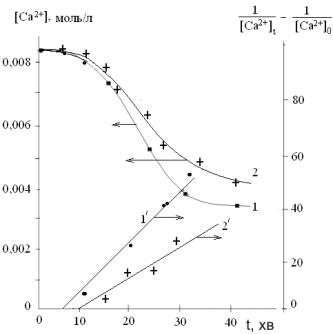
Рис.1. Кінетичні криві зменшення концентрації іонів кальцію та їх
анаморфози в координатах рівняння 2-го порядку при розкладанні кальцій
гідрокарбонату в умовах чистого досліду (1,1') та за присутності гідроген
пероксиду (10-4
моль/л) (2,2')
Присутність гідроген пероксиду в реакційній суміші викликає різноплановий
вплив на досліджуваний процес, що підтверджується складною залежністю
ефективної константи швидкості від концентрації гідроген пероксиду. Її характер
має хвилеподібний вигляд із чергуванням максимумів і мінімумів (рис.2).
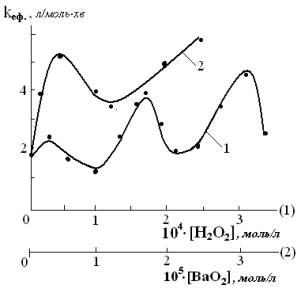
Рис.2. Залежність ефективної константи швидкості розкладання Са(НСО3)2 від концентрацій
гідроген пероксиду (1) та барій пероксиду (2)
Оскільки концентрації гідроген пероксиду невеликі, то одержаний ефект можна
вважати каталітичним. Можливо він пов’язаний із різними сольватаційними
явищами, як наприклад, на основі утворення адуктів за водневим зв’язком. Крім
того, можна допустити утворення кальцій пероксиду за реакцією [3]:
Са2+ + 2ОН– + Н2О2
⇄ СаО2
+ Н2О2
Оскільки
кальцій пероксид обмежено розчинний у воді, то, очевидно, утворений за
наведеною реакцією, він буде центром кристалізації
кальцій карбонату і, у такий спосіб сприяє прискореному переходу утвореного
карбонату з розчину в тверду фазу. Очевидно, саме такий ефект проявляється за
присутності барій пероксиду (рис.2).
Можливо
і сам гідроген пероксид впливає на формування центрів кристалізації, наприклад,
адсорбуючись на твердих поверхнях реактора сприяє зародженню центрів
кристалізації.
Література
1.
Применение перекиси
водорода для обработки городских и промышленных сточных вод, а также стоков со
свалок. –
1984. – №5. – С. 184-188.
2.
Иванов А. М., Михайловский В. Я., Галабицкий Б. В.,
Червинский К. А. Влияние гидродинамических факторов на устойчивость водных ростворов
гидрокарбоната кальция// Укр. хим. ж.. – 1978. – С. 721-724.
3.
Некрасов Б. В. Основы общей химии. – М.: Химия. – Т. 2. –
1973. – С. 162-168.