Балпанов Д.С.1,
Жусупов С.И.1, Головнева Н.А.2, Рябая Н.Е.2,
Найденко И.А.2, Щетко В.А.2, Самарцев А.А.2
1 Филиал РГП «Национальный центр биотехнологий», Казахстан
2 Институт микробиологии НАН Беларуси, Беларусь
Селекция желче- и кислотоустойчивых
штаммов пробиотических культур микроорганизмов
В последние годы препараты пробиотики рассматриваются как неотъемлемый компонент
фармакологического обеспечения современного промышленного животноводства и
птицеводства. Использование в ветеринарной практике пробиотических
препаратов позволяет улучшить процессы пищеварения, нормализовать обмен
веществ, повысить продуктивность сельскохозяйственных животных, улучшить
экономические показатели производства, добиться экологической безопасности
продукции [1]. С точки зрения терапевтической эффективности и технологичности
наиболее значимыми свойствами штаммов бактерий для включения в состав
препаратов пробиотиков являются экологическая принадлежность к физиологическим
симбионтам организма-хозяина, устойчивость к физиологическим стрессам
желудочно-кишечного тракта, к антимикробным препаратам, высокая адгезивность и
антагонистическая активность по отношению к патогенным и условно-патогенным
микроорганизмам [2, 3]. Наиболее полно в ветеринарной практике требованиям
безопасности и эффективности отвечают препараты, в состав которых входят
микроорганизмы из числа основных представителей нормального кишечного
биоценоза. В настоящее время показано, что молочнокислые и бифидобактерии
играют немаловажную роль не только в предупреждении заболеваний,
ассоциированных с чрезмерной контаминацией кишечной стенки макроорганизма
условно-патогенными бактериями с повышенными вирулентными свойствами, но и в
предупреждении транслокации возбудителей токсикоинфекций из кишечника
организма-хозяина в его органы и ткани [4, 5].
Лечебно-профилактические свойства пробиотических
препаратов обусловлены уникальными физиолого-биохимическими свойствами
специально отобранных штаммов молочнокислых и бифидобактерий. В настоящее время общепринятым критерием для
селекции производственных штаммов пробиотических микроорганизмов является
способность бактерий к выживанию и размножению в условиях кишечного
микроокружения, что предполагает устойчивость к низким значениям рН и
органическим кислотам, к физиологической концентрации желчи, солей натрия и
другим факторам. Адаптация и толерантность к желчному и кислотному стрессам
является лимитирующим фактором обитания бактерий в среде кишечника. Кроме того,
в присутствии солей желчи наблюдается значительное снижение устойчивости
бактерий к ряду антибиотиков и сульфаниламидов широкого спектра действия.
Например, в присутствии желчи отмечена повышенная чувствительность
бифидобактерий к аминогликозидам, пенициллинам, тетрациклинам, амфениколам,
макролидам, ансамицинам, линкозамидам. Признак устойчивости к желчи и солям
желчных кислот у бифидобактерий генетически детерминирован [6].
Цель
исследования – выделение и селекция желче- и кислотоустойчивых штаммов бактерий с пробиотической активностью,
исследование их свойств с целью создания лечебно-профилактического препарата
для животноводства.
В качестве культур,
перспективных для включения в состав пробиотического препарата, отобраны штаммы
бактерий родов Lactobacillus и Bifidobacterium, на основе которых
проведена селекция желче- и кислотоустойчивых вариантов бактерий. Культивирование бифидо-
и молочнокислых бактерий осуществляли в термостате при 37ºС на средах
различного состава MRS, Блаурокка, тиогликолевой,
казеиново-лактозной с дрожжевым экстрактом (КЛД), в зависимости от целей экспериментов.
В качестве посевного материала использовали физиологически активные (инокулят
III генерации, 18 час роста) культуры, 2-10 об, %, которых вносили в
питательные среды. Культивирование проводили в течение 1-4 суток.
Культивирование на твердых питательных средах
проводили в анаэробных условиях, используя систему для создания анаэробной
атмосферы «Анаэропак Н2 +СО2».
Биомассу бактерий определяли весовым методом,
высушивая отмытые клетки до постоянного веса при 105ºС, а также путем
измерения оптической плотности суспензии бактерий при 590 нм.
Количество жизнеспособных клеток бактерий в 1 мл
суспензии (число колониеобразующих единиц - КОЕ) определяли методом предельных
разведений при высеве на питательные среды, содержащие 0,2% агара. Активность
кислотообразования - титрометрическим и потенциометрическим методами.
Определение устойчивости к желчи проводили при
глубинном культивировании бактерий на среде КЛД, содержащей желчь сгущенную (1,
20 и 40 об. %) или сухую (1-5 %).
Устойчивость к желчи определяли по уровню накопления биомассы, изменению числа
КОЕ и активной кислотности среды культивирования.
Адаптацию бифидобактерий к желчи проводили
методом субкультивирования на среде КЛД, содержащей 1 об.% желчи в течение
четырех месяцев, кратность пересевов 2-3 раза в неделю. Для успешной адаптации
бифидобактерий к желчи требовалось не менее двух месяцев с условием постоянного
отбора устойчивых вариантов культуры. Для полученных вариантов свойство
устойчивости к желчи сохраняется при длительном хранении на среде КЛД с 1
об.% желчи в условиях умеренной
гипотермии (4-6ºC).
Антагонистическую активность бактерий определяли
общепринятыми методами на жидких (метод предельных разведений) и агаризованных
(метод диффузии в агар) питательных средах.
Активность α- и β-галактозидаз
определяли колориметрически по количеству освободившегося о-нитрофенола из,
соответственно, о-нитрофенил-α-D-галактопиранозида и о-нитрофенил-β-D-галактопиранозида
при 370С после 60 мин инкубации.
Проведена селекция
штамма бифидобактерий Bifidobacterium sp. по признаку устойчивости к солям желчных кислот и штамма лактобацилл Lactobacillus sp. по уровню
кислотоустойчивости.
Показатели желчеустойчивости штамма
бифидобактерий приведены в таблице 1. В присутствии желчи в концентрациях 20% и
40% наблюдается незначительный прирост биомассы, снижение показателей
активности роста и кислотообразования. Интенсивность накопления биомассы в
динамике развития популяций бифидобактерий зависит от концентрации желчи в
среде культивирования.
Таблица 1
Исследование устойчивости к желчи культуры Bifidobacterium sp.
|
Контроль |
Концентрация желчи |
||||||||
|
20 % |
40 % |
||||||||
|
Время роста, ч |
Био-масса, мг/мл |
Актив-ность роста, КОЕ/мл |
рН |
Био-масса,
мг/мл |
Актив-ность роста, КОЕ/мл |
рН |
Био-масса,
мг/мл |
Актив-ность
роста, КОЕ/мл |
рН |
|
0 |
0,08 |
4·107 |
6,6 |
0,11 |
2·107 |
6,4 |
0,108 |
9·106 |
6,3 |
|
24 |
0,95 |
2,6·1010 |
4,7 |
0,26 |
3·102 |
5,9 |
0,145 |
0 |
6,1 |
|
48 |
0,96 |
1,3·109 |
4,5 |
0,25 |
0 |
5,9 |
0,145 |
0 |
6,1 |
В результате селекции по признаку активного
роста на средах, содержащих желчь, отобран вариант штамма Bifidobacterium sp.,
характеризующийся активным ростом в присутствие 1 % желчи в среде (таблица
2).
Таблица 2 Показатели роста вариантов культуры бифидобактерий,
полученных методом адаптивной селекции на среде КЛД с желчью
|
Варианты |
Активность роста*, КОЕ/мл |
Биомасса*, мг/мл |
|
Культуры после трех пассажей на среде КЛД с 1 %
желчи |
7.4×107 |
0.67 |
|
Культура, адаптированная методом субкультивирования
на среде КЛД с 1 % желчи в течение 4 месяцев. |
1.5×1010 |
0.92 |
*-
24 ч культивирования на среде КЛД с 1 % желчи; средние показатели 3-5 измерений
Полученный штамм обладает не только высокой
активностью роста и кислотообразования, но проявляет и ферментативную
активность – протеолитическую, α- и β-галактозидазную (рисунок 1).
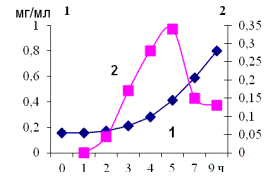
Рисунок
1 - Показатели роста (1 – биомасса,
мг/мл, 2 – удельная скорость роста,
μ, ч) и ферментативной активности B. adolescentis В01-12 на среде КЛД при использовании 10%
инокулята
В результате
адаптивной селекции по признаку кислотоустойчивости получен штамм Lactobacillus sp.
Селектированные лактобациллы выдерживают инкубирование при рН 2,1 в течение 2
часов без снижения тира жизнеспособных клеток, характеризуются высокой
активностью роста и кислотообразования на средах разного состава, а также
продуцируют экзополисахарид
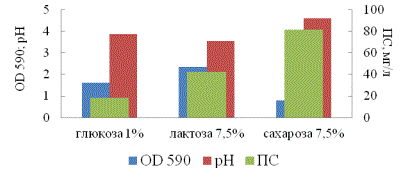
(рисунок 2).
|
. |
Рисунок
2 – Накопление биомассы (OD 590),
кислотообразование (рН) и содержание полисахарида (ПС) на питательных средах,
содержащих разные углеводы
Таким образом, в результате адаптивной селекции
получены желчеустойчивый штамм бифидобактерий и кислотоустойчивый штамм
молочнокислых бактерий,
перспективные для использования в составе лечебно-профилактического
препарата для животноводства.
Литература:
1
Малик Н. И., Панин А. И. Ветеринарные пробиотические препараты // Ветеринария.
– 2001. – № 1 – С. 46-51.
2 Лесняк С.В. Характеристика производственных
штаммов-продуцентов колибактерина, бифидумбактерина и лактобактерина по
антагонистической активности, устойчивости к антибиотикам и жизнеспособности /
Отчет ГИСК – М.: 1982 – №02820084317. – 28 с.
3
Fujiwara S., Hashiba H., Hirota T. and Forstner J.F. Proteinaceous factor(s) in culture supernatant fluids of bifidobacteria
which prevents the binding of enterotoxigenic Escherichia coli to
gangliotetraosylceramide // Appl. Environ. Microbiol. – 1997. – V 63, Nо. 2. – P. 506-512.
4 Lie´vin-Le Moal V., Servin A. L. The front
line of enteric host defense against unwelcome intrusion of harmful microorganisms:
mucins, antimicrobial peptides, and microbiota // Clinical microbiology reviews
– 2006. – V.19, No.2 – P. 315-337.
5 Asahara T., Nomoto K.,
Shimizu K., Watanuki M., Tanaka R. Increased resistance of mice to Salmonella enterica serovar Typhimurium infection by
synbiotic administration of Bifidobacteria and transgalactosylated oligosaccharides // J Appl
Microbiol. – 2001. – V.91, Nо.6. – P. 985-996.
6 Ruiz L., Ruas-Madiedo P., Gueimonde M., de los
Reyes-Gavila´n C.G., Margolles
A., Sa´nchez B. How do bifidobacteria counteract environmental
challenges? Mechanisms involved and physiological consequences// Genes Nutr. –2011.
– Nо.6. – P. 307-318.