Бешенцева О.А.
Доцент кафедри
природничих і гуманітарних дисциплін
Харківського національного автомобільно-дорожнього університету
м. Харків, Україна
КИНЕТИКА ХИМИЧЕСКОГО ВОССТАНОВЛЕНИЯ
МЕТАЛЛОВ
ИЗ ВОДНЫХ РАСТВОРОВ В УСЛОВИЯХ
ГИДРОДИНАМИЧЕСКОГО РЕЖИМА
Одной из важных проблем современной физической
химии и материаловедения остается химическое осаждение металлов на поверхностях
материалов с различным уровнем электропроводности.
Детали из диэлектриков с металлическими
покрытиями широко используются автомобилестроении, радиотехнике и других
отраслях. Особенно большое значение процессы химической металлизации
диэлектриков имеют в производстве печатных плат – основе электронных приборов и
радиотехнических изделий.
Известно, что одним из
способов интенсификации химических процессов является перемешивание в
жидких средах [1]. Поэтому в наших исследованиях
изучены физико-химические закономерности процессов химического осаждения
металлов на различных подложках в условиях гидродинамического массопереноса.
Ранее нами был установлен эффект гидродинамического
ограничения скорости (ГДОС) для реакции химического восстановления олова на
диэлектриках (Д) по реакции диспропорционирования [2]. Эффект ГДОС
заключается в том, что при достижении определенной скорости перемешивания
раствора путем вращения диэлектрического образца скорость химической
металлизации становится равной нулю [3-5].
Эффект ГДОС был распространен на другие гетерогенные реакции
химического восстановления: Cu(II)
→ К(Д), Pb(II) → Al, Pb(II)
→ Cu. Для систем химической металлизации диэлектриков и металлов было показано,
что в области ламинарных режимов скорость восстановления возрастает, а при
переходе от ламинарного к турбулентному – снижается, вплоть до нуля.
Результаты анализа физических, кинетических,
гидродинамических факторов показали, что эффект ГДОС связан с явлением
вытеснения разряжающихся частиц из реакционного слоя на границе раздела фаз
Д/раствор вследствие увеличения центробежной силы (Fц). При этом
закономерно уменьшается сила связи (Fсв), время полуреакции разряда
металлических ионов на каталитической поверхности, количество реакционных
частиц в межфазном слое, что приводит к полному подавлению процесса химического
восстановления на каталитической поверхности.
Нами предложены следующие условия проявления
эффекта ГДОС:
Fсв > Fц – процесс химической металлизации реализуется;
Fсв
< Fц – процесс химической металлизации полностью
прекращается.
Между тем, возможна другая интерпретация эффекта
ГДОС. В случае двухвалентных ионов металлов могут протекать процессы частичного
восстановления согласно: Ме2+ + е = Ме+1. Ионы Ме+1
в растворе не образуют металлический осадок и не фиксируются ни визуально, ни
гравиметрически на Д-образце.
Для исключения таких представлений нами проведено дальнейшее
исследование в системе химического восстановления аммиачных комплексов однозарядных
ионов серебра Ag+ в присутствии различных восстановителей.
Объектами исследования служили Д-образцы –
цилиндрические стеклянные пробирки длиной 0,08 м и диаметром 0,01 м.
Поверхность Д-образцов обезжиривали, сенсибилизировали и активировали по
различным методикам [6.7]. Реакцию химического осаждения серебра проводили в
постоянных объемах (100 мл) растворов различного состава химического серебрения.
Температура 293 К. Время во всех опытах 600 с. По результатам гравиметрии
образцов до и после опыта рассчитывали скорость химического серебрения и толщины
Ме-слоя. При заданных параметрах исследования проводили не менее 5 раз (сходимость
удовлетворительна, относительная ошибка до 0,5%). Растворы готовили из реактивов
квалификации «ч.д.а.» на бидистиллированной воде.
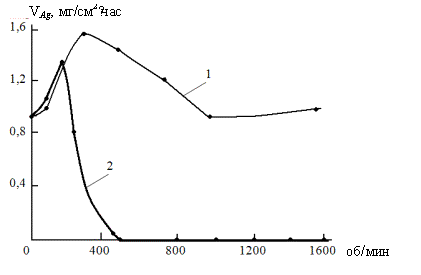 Результаты выполненных
экспериментов представлены на рисунке.
Результаты выполненных
экспериментов представлены на рисунке.
Рис. Влияние скорости вращения образца (ω) на скорость
осаждения серебра (VAg) в разных растворах химического серебрения.
Обозначения: 1 – раствор без Co(II)/Co(III), 2 – раствор с
Co(II)/Co(III).
Анализ полученных данных показал, что в случае
химического восстановления Ag+-ионов установлена
классическая диффузионная ветвь зависимостей VAg – ω. После достижения
максимума на этих зависимостях наблюдается снижение скорости химической металлизации,
однако в области ω = 900 – 1000 об/мин наблюдается стабилизация скорости
металлизации с выходом на плато. При этом на вращающемся образце образуются
очень тонкие слои серебра, практически нанослои (60-200) · 10–9 м.
Из анализа данных рисунка следует, что эффект
ГДОС наблюдается в ограниченном интервале значений ω = 300 – 900 об/мин. Предположено,
что решающее значение для эффекта ГДОС имеет повышение концентрации
разряжающихся частиц в реакционном слое за счет образования мелкодисперсного
осадка серебра и мелкодисперсных продуктов окисления восстановителя как в
объеме и со стенками реактора, так и с осадком серебра на Д-образце.
Предположено, что эффект ГДОС полностью
проявится, если продолжительность опыта (τоп.) будет меньше,
чем время индукционного периода (τинд.) В условиях, когда
τоп. < τинд. обнаружить визуально
коллоидоподобное состояние системы
химического серебрения невозможно, т. к. процессы образования коллоидных частиц
осуществляются на наноуровне, что не поддается визуальной фиксации. Такие
процессы необходимо контролировать с помощью специальных оптических методов.
Дальнейшие исследования процесса химического серебрения
диэлектрика касались стремления достичь полного отсутствия процессов
образования продуктов восстановления в объеме раствора и на стенках реактора в
течение всего опыта. Указанным условиям отвечает система химического
серебрения, содержащая аммиачные растворы Со(II), т.к. ионы Со(II)
в этих растворах образуют устойчивые комплексы типа [Co(NH3)6]2+
и поэтому потенциал стандартной окислительно-восстановительной системы Со(II)/Со(III),
равный +1,84 В, резко смещается в область менее положительных значений. В этом
случае реакция восстановления серебра протекает только на поверхности
активированного Д по автокаталитическому механизму в соответствии с уравнением:
[Ag(NH3)2]+
+ [Co(NH3)6]2+ + 2H2O = Ag↓ +
[Co(NH3)6]3+ + 2NH4OH.
В
данной системе впервые показана возможность полного проявления эффекта ГДОС металлизации
активированного Д.
Результаты полностью подтверждают наши
представления о механизме эффекта ГДОС на вращающемся Д-образце, вследствие
отталкивания однозарядных частиц серебра от поверхности Д, а не в результате
последовательного одноэлектронного перехода, как это можно было бы представить
в случае химического восстановления многозарядных частиц.
На основе полученных экспериментальных
результатов изучена система химического серебрения в присутствии
окислительно-восстановительной системы Со(II)/Со(III) на активированном Д по
автокаталитическому механизму без осаждения металла в объеме раствора.
Полученные новые экспериментальные
результаты о влиянии состава растворов и условий проведения опытов на скорость
химического осаждения серебра на диэлектриках можно применять: - при разработке новых технологий химической
металлизации с целью интенсификации этих процессов; - для внедрения
новых конструктивно-технических решений с целью удешевление производства
аппаратуры, машин, предметов широкого потребления; - в качестве инструмента моделирования процессов гидродинамики на межфазных
границах металл/раствор.
Литература
1. Химическое
осаждение металлов из водных растворов / В.В. Свиридов, Т.Н. Воробьева, Т.В.
Гаевская, Л.И. Степанова / Ред. В.В. Свиридова. – Мн.: Изд-во Университетское,
1987. – 270 с.
2. Бешенцева О.А.
Особенности кинетики химического восстановления металлов из растворов на диэлектриках в условиях критического
гидродинамического режима / О.А. Бешенцева, В.Д. Калугин, Н.С. Опалева
// Вісник Харківського нац. ун-ту. Хімія. – 2005. – Вип. 12(35), № 648. – С.
127 – 130.
3. Калугин В.Д. Анализ кинетических и
энергетических факторов при восстановлении металлов в гидродинамическом режиме
/ В.Д. Калугин, О.А. Бешенцева // Украинский
химический журнал. – Киев. – 2009. – Т. 75, №1. – С. 33-37.
4. Beshentseva О.А. The Peculiarities of the Kinetics
of Silver Chemical Deposition on Dielectrics with Various Technologies of the
Surface Activation / О.А. Beshentseva, V.D. Kalugin, N.S.
Opaleva, O.V. Sidorenko // Surface Engineering and Applied Electrochemistry. – 2010. – Vol. 46,
No. 1. – P. 16-20.
5. Калугин В.Д. Эффект гидродинамического ограничения скорости
химического серебрения диэлектриков в растворах с образованием дисперсий в
объеме реактора / В.Д. Калугин, Н.С.
Опалева, О.В. Сидоренко, О.А. Бешенцева // Мат-ли VI
Міжнар.
наук. конф. «Фізико-хімічні формування і модифікації мікро- та наноструктур», 10-12 жовтня 2012. – Харків: МОНМС
та НАНУ. 2012. –
С. 9-14.
6. Шалкаускас М., Вашкялис
А. Химическая металлизация пластмасс. – Л.: Химия, 1985. – 144 с.
7. Ардамацкий А.Л.
Изготовление оптических деталей: Учебное пособие / Под ред. С.И. Фрейберга. – М.: Гос. Изд-во оборонной промышленности,
1955. – С. 465-477.