Булатовский А.Б.,
Силицкая Е.Н., Ерошевская Л.А., Квач С.В.,
Рымко А.Н., Зинченко
А.И.
Институт микробиологии НАН Беларуси, Минск
Международный государственный экологический университет
им. А.Д. Сахарова, Минск
Создание генно-инженерного
штамма-суперпродуцента декстрансахаразы
Декстран (групповое название
полисахаридов, основная молекулярная цепь которых состоит из
ангидроглюкопиранозных звеньев, соединенных преимущественно
α-1,6-гликозидными связями) получают при культивировании микроорганизмов Leuconostoc mesenteroides, Leuconostoc dextranicum, Streptobacierium dextranicum
и др. в среде, содержащей сахарозу или другие углеводы, в состав которых входят
ангидро-О-глюкопиранозные звенья [1,
2].
Декстраны широко используются в качестве
заменителя плазмы крови, повышения вязкости растворов в молочной и пищевой
промышленности, изготовления сефадекса, используемого в биохимической
промышленности.
Синтез декстрана под действием
декстрансахаразы происходит путём присоединения глюкозильных остатков к
восстанавливающим концам полисахаридных цепей декстрана. Известно, что при
культивировании L. mesenteroides на
питательной среде, содержащей сахарозу или мелассу в качестве источника
углерода и энергии, декстрансахараза в значительной степени выделяется в среду
[3]. Однако, получение декстрансахаразы из L.
mesenteroides является трудоемким, за счет продукции слабоактивного
фермента и сложности культивирования представителей этого вида бактерий.
Поэтому для синтеза декстрансахаразы в литературе был предложен ряд штаммов
вида L. lactis [4].
Предполагалось, что в клетках этих бактерий синтез фермента идти более эффективно.
Целью настоящего
исследования было создание генно-инженерного штамма L. lactis-суперпродуцента
декстрансахаразы L. mesenteroides.
Материалы
и методы исследования. Клонирование гена ΔdsrD (GenBankID: AY017384.1), кодирующего
декстрансахаразу L. mesenteroides,
осуществляли методом продолжительной перекрывающейся ПЦР (ПП-ПЦР) [5, 6]. Ген
выделяли из ДНК бактерий L. mesenteroides
методом ПЦР с использованием «Phusion High-Fidelity»-ДНК-полимеразы
(«Fermentas», Литва) и двух олигонуклеотидных праймеров («Праймтех», Беларусь):
F (5′-GTGGTGGTCCACAACACACAACA-AGTTAGCGGC-3′) и R
(5′-GGTGATGGTGATGACTCAAGTTAGTATCTGG-ATC-3′). К 5′-концам праймеров были
добавлены нуклеотидные последовательности (выделены подчеркиванием),
комплементарные плазмиде pNZ8121 («MoBiTec»,
Германия). На втором этапе линеаризовали вектор методом ПЦР с использованием
«Phusion High-Fidelity»-ДНК-полимеразы и двух олигонуклеотидных праймеров: F
(5′-GAGCATCACCATCACCACCACTGATAAAGCAAT-TACTGATATTGC-3′) и R
(5′-GTTGTGGACCACCACCGCCTTTGCTTGGAT-3′). На третьем этапе собирали
линеаризованный вектор и ген методом ПП-ПЦР по следующей программе: этап
предденатурации 2 мин при 95°С; 16 циклов амплификации: 30 с при 95°С, 30 с при
55°С, 4 мин при 72°С; финальная элонгация – 6 мин при 72°С. На этом этапе в качестве
матрицы и затравки использовали фрагменты, полученные на первых двух этапах.
Синтезированным
с помощью ПП-ПЦР продуктом трансформировали компетентные клетки L. lactis NZ3900 («MoBiTec»,
Германия), c последующим высевом на плотную питательную среду LB [7], с
добавлением хлорамфеникола (10 мкг/мл). Выросшие колонии анализировали на
наличие плазмиды со встроенным геном ΔdsrD методом ПЦР. В результате была создана генетическая
конструкция, обозначенная pNZ8121ΔdsrD. В данной
конструкции имеется сигнальный пептид, который ответственный за экскрецию
декстрансахаразы наружу клетки.
Клетки-трансформанты
культивировали при 30ºС на среде LB до оптической плотности 0,5
(λ=600 нм), затем проводили индукцию синтеза, путем внесения в среду
низина до концентрации 0,5 мг/мл и продолжали культивировать на протяжении 24 ч
при 15°С. По окончании выращивания клетки осаждали центрифугированием. В полученном
супернатанте определяли активность фермента. При этом, за единицу активности
фермента принимали, такое количество, которое обеспечивало образование фруктозы
из сахарозы в количестве 1 мкмоль за 1 мин.
Результаты
и их обсуждение. Перед нами была поставлена цель ‒ сконструировать новый
рекомбинантный штамм-продуцент декстрансахаразы путем клонирования гена декстрансахаразы из L.
mesenteroides не в гомологичных клетках, а
в клетках геторологичного микроорганизма ‒ L. lactis. Предполагалось,
что это позволит увеличить выход фермента, упростит и удешевит культивирование.
На первом этапе
работы с помощью методов генетической инженерии [5] была сконструирована
плазмида pNZ8121ΔdsrD
(рис. 1). Далее ею были трансформированы компетентные клетки L. lactis NZ3900. В итоге был создан
штамм-продуцент декстрансахаразы L. lactis pNZ8121ΔdsrD.
~7000 п.о.
![]()
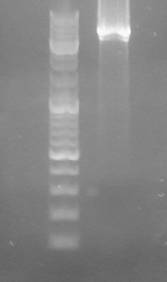
М 1
Рис. 1. Электрофореграмма созданной генетической
конструкции
М – фрагменты ДНК с известным
количеством пар оснований. 1 – конструкция pNZ8121ΔdsrD
На втором этапе
полученный штамм выращивали на питательной среде LB до оптической плотности 0,5
(λ=600 нм) с последующей индукцией синтеза белка путем внесения индуктора
(низина) до конечной концентрации 0,5 мг/мл. После окончания культивирования (24
ч) клетки осаждали путем центрифугирования и в полученном супернатанте
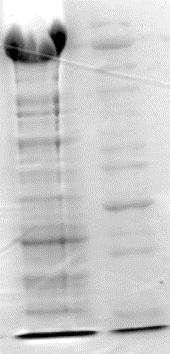
определяли активность экскретированного фермента, уровень экспрессии и чистоту
при помощи SDS-электрофореза в полиакриламидном геле (рис. 2). Продуцирующая
способность нового рекомбинантного штамма L. lactis pNZ8121ΔdsrD в среднем составила 145 000 ед/л КЖ, что
превышает в 3 раза активность известного штамма-прототипа ‒ L. mesenteroides-Lcc4.
Рис. 2. Электрофореграмма белкового состава супернатанта
с
декстрансахаразой
М – маркерные белки, с известной
молекулярной массой. 1 – супернатант
Заключение. В результате выполнения работы был сконструирован
штамм L. lactis pNZ8121ΔdsrD, продуцирующий гетерологичную
рекомбинантную декстрансахаразу.
Литература:
1. Rosi N.L., Mirkin C.A. Nanostructures in
Biodiagnostics // Chem. Rev. 2005. Vol. 105. P. 1547–1562.
2. Wang X. et al. The atmospheric and
room-temperature plasma (ARTP) method on the dextranase activity and structure //
Int. J. Biol. Macromol. 2014. Vol. 70. P.
284–291.
3. Otts D.R., Day D.F. Dextransucrase secretion in Leuconostoc mesenteroides depends on the
presence of a transmembrane proton gradient // J. Bacteriol. 1988. Vol. 170, N
11. P. 5006–5011.
4. Neubauer H., Baucheґl A., Mollet B. Molecular
characterization and expression analysis of the dextransucrase DsrD of Leuconostoc mesenteroides Lcc4 in homologous
and heterologous Lactococcus lactis
cultures // Microbiol. 2003. Vol. 149. P. 973–982.
5. Sambrook,
J. Molecular cloning: a laboratory manual / J. Sambrook, P. MacCallum, D.
Russell // Cold Spring Harbor Laboratory Press. – 3rd ed. – New York, 2000. –
2222 p.
6. Quan J., Tian J. Circular polymerase extension cloning
of complex gene libraries and pathways // PLoS ONE. 2009. Vol. 4, N 7. e6441.
7. Studier
F.W. Protein production by auto-induction in high-density shaking cultures //
Protein Expr. Purif. 2005. Vol. 41, N 1. P. 207–234.