Квантово-химический
расчет молекулы ментола методом MNDO.
Себряковский филиал Волгоградский государственный архитектурно –
строительный университет.
Бабкин В.А., Цыканов А.В., Андреев Д.С.
Несмотря на то что ментол был синтезирован
ещё в конце 19 века и более того, за изучение его оптических свойств и других
алициклических соединений была получена Нобелевская премия, до сих пор не были
выполнены квантовохимические расчеты методом MNDO этого соединения .
В связи с этим,целью настоящей работы
является квантово-химический расчет молекулы ментола методом MNDO [1] с оптимизацией геометрии по всем параметрам
стандартным градиентным методом встроенным в
PC GAMESS, в
приближении изолированной молекулы в газовой фазе и теоретическая оценка его
кислотной силы. Для визуального представления модели молекулы использовалась
известная программа MacMolPlt[3].
Результаты
расчетов ментола
Оптимизированное
геометрическое и электронное строение, общая энергия и электронная энергия
молекулы ментола получена методом MNDO и показаны
на рис.1 и в табл.1. Используя известную формулу рКа=42.11-147.18qmaxH+ (qmaxH+ =+0.179 - максимальный заряд на атоме
водорода, рКа- универсальный показатель кислотности см. табл.1) находим значение
кислотной силы равное рКа=15.76
Таким образом, нами
впервые выполнен квантово-химический расчет молекулы ментола методом MNDO. Получено оптимизированное геометрическое и
электронное строение этого соединения. Теоретически оценена его кислотная сила
рКа=15.76. Установлено, что ментол относится к классу очень слабых Н-кислот(рКа>14).
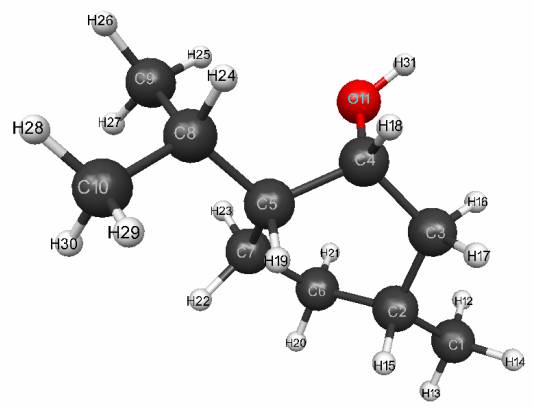
рис.1.
Геометрическое и электронное строение молекулы ментола
(Е0= -181797 кДж/моль,
Еэл= -1082046 кДж/моль )
Оптимизированные
длины связей, валентные углы и заряды атомов молекулы ментола.
|
Дины связей |
R,A |
Валентные углы |
Град |
Атом |
Заряд (по Милликену) |
|
C(2)-C(1) |
1.54 |
|
|
C(1) |
0.041 |
|
C(3)-C(2) |
1.55 |
C(3)-C(2)-C(1) |
112 |
C(2) |
-0.05 |
|
C(4)-C(3) |
1.56 |
C(4)-C(3)-C(2) |
116 |
C(3) |
-0.02 |
|
C(5)-C(4) |
1.57 |
C(5)-C(4)-C(3) |
111 |
C(4) |
0.131 |
|
C(6)-C(2) |
1.54 |
C(6)-C(2)-C(1) |
112 |
C(5) |
-0.00 |
|
C(7)-C(5) |
1.54 |
C(7)-C(5)-C(4) |
111 |
C(6) |
0.002 |
|
C(8)-C(5) |
1.56 |
C(8)-C(5)-C(4) |
114 |
C(7) |
0.007 |
|
C(9)-C(8) |
1.54 |
C(9)-C(8)-C(5) |
117 |
C(8) |
-0.04 |
|
C(10)-C(8) |
1.54 |
C(10)-C(8)-C(5) |
111 |
C(9) |
0.043 |
|
O(11)-C(4) |
1.40 |
O(11)-C(4)-C(3) |
111 |
C(10) |
0.036 |
|
H(12)-C(1) |
1.10 |
H(12)-C(1)-C(2) |
112 |
O(11) |
-0.31 |
|
H(13)-C(1) |
1.10 |
H(13)-C(1)-H(12) |
107 |
H(12) |
-0.00 |
|
H(14)-C(1) |
1.10 |
H(14)-C(1)-H(12) |
107 |
H(13) |
-0.00 |
|
H(15)-C(2) |
1.12 |
H(15)-C(2)-C(1) |
105 |
H(14) |
-0.00 |
|
H(16)-C(3) |
1.11 |
H(16)-C(3)-C(4) |
109 |
H(15) |
0.010 |
|
H(17)-C(3) |
1.11 |
H(17)-C(3)-H(16) |
105 |
H(16) |
0.009 |
|
H(18)-C(4) |
1.12 |
H(18)-C(4)-C(5) |
107 |
H(17) |
0.002 |
|
H(19)-C(5) |
1.12 |
H(19)-C(5)-C(7) |
105 |
H(18) |
-0.01 |
|
H(20)-C(6) |
1.11 |
H(20)-C(6)-C(7) |
108 |
H(19) |
0.003 |
|
H(21)-C(6) |
1.11 |
H(21)-C(6)-H(20) |
105 |
H(20) |
0.002 |
|
H(22)-C(7) |
1.11 |
H(22)-C(7)-C(5) |
108 |
H(21) |
0.011 |
|
H(23)-C(7) |
1.11 |
H(23)-C(7)-H(22) |
105 |
H(22) |
-0.00 |
|
H(24)-C(8) |
1.12 |
H(24)-C(8)-C(5) |
106 |
H(23) |
0.015 |
|
H(25)-C(9) |
1.10 |
H(25)-C(9)-C(8) |
112 |
H(24) |
0.006 |
|
H(26)-C(9) |
1.11 |
H(26)-C(9)-H(25) |
106 |
H(25) |
0.010 |
|
H(27)-O(11) |
4.01 |
H(27)-O(11)-C(9) |
13 |
H(26) |
-0.01 |
|
H(28)-C(10) |
1.10 |
H(28)-C(10)-H(26) |
65 |
H(27) |
-0.00 |
|
H(29)-C(10) |
1.10 |
H(29)-C(10)-H(28) |
106 |
H(28) |
-0.00 |
|
H(30)-H(23) |
3.47 |
H(30)-H(23)-C(10) |
17 |
H(29) |
-0.00 |
|
H(31)-O(11) |
0.94 |
H(31)-O(11)-H(27) |
145 |
H(30) |
-0.00 |
|
|
|
|
|
H(31) |
0.179 |
Литература.
1. M.W.SHMIDT, K.K.BALDROSGE, J.A. ELBERT, M.S. GORDON, J.H. ENSEH, S.KOSEKI, N.MATSVNAGA., K.A. NGUYEN, S. J. SU, and anothers. J. COMPUT. CHEM.14,1347-1363,(1993).
2. Babkin V.A.,
Fedunov R.G., Minsker K.S. and anothers. Oxidation communication, 2002,№1, 25, 21-47.
3. Bode, B. M. and
Gordon, M. S. J. Mol. Graphics Mod., 16, 1998, 133-138.