Зиганшин
Н., студент
Харьковский
национальный автомобильно – дорожный универистет
ИЗУЧЕНИЕ ПРОЦЕССА
ТРАВЛЕНИЯ МЕДНЫХ СПЛАВОВ
Современное развитие промышленности
приводит к техногенной опасности в отдельных регионах, существенно повышает
сброс в промышленный сток больших объемов концентрированных технологических
растворов. Такие растворы сбрасывают предприятия радиоэлектронной и
приборостроительной отраслей промышленности, где используется технологии
травления металлов. Для размерного травления изделий из меди и ее сплавов
широко используются травильные растворы на основе хлоридов железа (III) и меди
(II). Суммарную реакцию травления меди раствором хлорида железа (III) можно
выразить уравнением
Cu + 2FeCl3 = CuCl2 +
2FeCl2.
В процессе травления меди в растворе
накапливаются ее ионы, а концентрация окислителя уменьшается, в результате чего
скорость травления снижается во времени, травильный раствор считается
непригодным для дальнейшего использования.
Кроме того, в окружающую среду залпом поступает большое количество
токсичных соединений меди (I), (II), железа (II), (III). Наносится непоправимый
ущерб окружающей природной среде. В связи с этим очень важным является
исследование процессов химического растворения сплавов меди в растворах
различного состава.
Целью работы являлось исследование химического растворения латуни Л – 62 в растворах различного
состава. Растворение сплава изучали
методом вращающегося дискового электрода (ВДЭ).
Скорость растворения латуни определяли с
помощью экспериментальных методов исследования гравиметрического и
атомно-абсорбционного. Согласно результатам гравиметрических измерений среднюю
скорость растворения сплава вычисляли по формуле:
![]() , кг · м–2 ·
с–1, (1)
, кг · м–2 ·
с–1, (1)
где
m0 и m – соответственно массы образца до и после растворения, кг;
S – геометрическая площадь поверхности медного образца
(во всех экспериментах S = 0,45·10–4 м2);
τ – время растворения, с.
Выбор электролитного состава растворов был обусловлен
их практическим использованием в процессах размерного травления меди и латуней.
По результатам гравиметрических измерений были построены графические
зависимости скорости растворения (v)
латуни Л-62 от концентраций исходных травильных растворов (С). ). Ход изменения скорости растворения латуни Л-62 различный в
электролитах разной природы. В основном он определяется эффективностью
процессов окисления-восстановления компонентов латуни или комплексообразования
ионов меди и цинка с лигандами раствора. Выделение приоритетного фактора можно
осуществить при сравнении кривых v – C для растворов NaCl и FeCl3. В
растворах NaCl с увеличением концентрации ионов хлора скорость растворения
латуни уменьшается.
Качественно противоположные изменения
скорости растворения при увеличении концентрации растворов хлорида железа(III).
Присутствие дополнительного фактора - ионов железа(III), обладающих высокой
окислительной способностью, приводит к существенному возрастанию скорости
растворения латуни с ростом их концентрации. Таким образом, из двух факторов,
способствующих увеличению скорости растворения латуни: увеличения концентрации
лигандов (Cl-) для комплексов ионов меди и цинка и увеличения
концентрации ионов-окислителей (Fe3+), ведущим является второй
фактор. Скорость растворения латуни в растворе FeCl3 на два порядка
выше по сравнению с другими электролитами. Монотонное увеличение скорости
растворения латуни с ростом концентрации FeCl3 косвенно свидетельствует
о практическом отсутствии плотных слоев пассивиурющих соединений на поверхности
сплава. Это было подтверждено методом рентгенофазового анализа, показавшего
присутствие лишь следовых количеств соединений CuAlO2 и, возможно,
Cu2O на поверхности сплава.
Атомно-абсорбционный анализ проводили с использованием
спектрофотометра «Сатурн» при длине волны для цинка – 213,9 нм, для меди – 324,8 нм. С помощью данного метода по
концентрациям ионов металлов, перешедших в раствор, оценивали как скорость
травления, так и селективность растворения сплава.
Коэффициенты селективности рассчитывали по формуле:
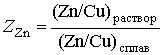 , (2)
, (2)
Рассчитанные значения коэффициентов
селективности цинка и меди подтверждают, что обесцинкование сплава характерно
для травления в растворах NaCl и NH4Cl. Для электролита FeCl3 характерна
хорошая корреляция графических зависимостей скорости растворения латуни и
перехода в раствор ее компонентов в зависимости от концентрации исходного
раствора. Используя расчетные данные по Z, нельзя сделать однозначный вывод о селективности
растворения какого-либо компонента. Для выяснения данного обстоятельства были
проведены прямые измерения содержания компонентов сплава с помощью
электронно-зондового микроанализа. Обнаружено достаточно выраженное обесцинкование
поверхностного слоя латуни после длительного травления в растворе FeCl3, а
именно: содержание цинка уменьшилось с 37,94% до 27,74%, а меди - увеличилось с 61,63% до 66,44%.