Химия и химическая технология
УДК 544.6; 542.2
д.т.н., проф.
Родионов И.В.
Саратовский
государственный технический университет
имени Гагарина
Ю.А., Россия
Статья подготовлена при финансовой поддержке
Минобрнауки РФ
в рамках ФЦП «Научные и научно-педагогические
кадры инновационной России» на 2009–2013 годы, соглашение
№ 14.B37.21.0571.
Особенности технологии анодирования медицинских титановых имплантатов
при создании оксидных покрытий с качествами биосовместимости
Аннотация
Рассмотрена возможность создания анодно-оксидных биосовместимых покрытий на медицинских титановых имплантатах. Исследовано влияние условий анодного оксидирования титана на основные характеристики покрытий, определяющие уровень их совместимости с биоструктурами и функциональными нагрузками. Разработана технология получения анодированных титановых имплантатов и даны рекомендации по формированию оксидных покрытий с качествами биологической совместимости.
Ключевые
слова: технология анодирования, оксидные покрытия, титановые имплантаты,
биосовместимость.
The summary
Creation possibility anod-oxides
biocompatible coverings on medical titanic implants is considered. Influence of
conditions anode oxidized the titan on the basic characteristics coverings
defining level of their compatibility with biostructures and functional
loadings is investigated. The technology reception anodized titanic implants is
developed and recommendations about formation oxides coverings with qualities
of biological compatibility are given.
Keywords: technology anodized, oxides coverings,
titanic implants, biocompatible.
Введение
Анодное оксидирование металлоизделий уже давно является распространенным и эффективным методом получения износостойких, коррозионностойких, диэлектрических, декоративных и др. функциональных покрытий с важнейшими эксплуатационными характеристиками. Анодно-оксидные поверхностные слои изделий значительно увеличивают срок их службы в условиях трения, химической и электрохимической коррозии, воздействия высоких температур, механических нагрузок.
Исследования последних лет показывают перспективность применения анодного оксидирования в производстве таких медико-технических изделий как костные имплантаты, которые широко используются в современной стоматологии при восстановлении утраченных зубов, а также в травматологии и ортопедии при исправлении деформаций и лечении переломов костей опорно-двигательного аппарата [1-3]. Присутствие оксидного покрытия на поверхности имплантатов обеспечивает высокий уровень их адаптации к различным тканям и средам организма, а также прочную взаимосвязь оксидированной поверхности с окружающими костными структурами.
Стоматологические и ортопедические имплантаты, в большинстве случаев выполняемые из титана и его сплавов, должны иметь развитый микрорельеф поверхность с комплексом физико-химических и механических свойств, обеспечивающих благоприятные условия для эффективного взаимодействия с окружающими биоструктурами. В результате такого взаимодействия должна создаваться прочная биотехническая система «имплантат – биоткань», характеризуемая биоинтеграцией. Необходимые биоинтеграционные качества поверхности имплантатов могут придаваться с помощью анодного формирования оксидных покрытий в специально подобранных электролитах. При этом получаемые покрытия способны к проявлению биосовместимости за счет высоких показателей шероховатости и морфологической гетерогенности поверхности, коррозионной стойкости, механических свойств, а также благоприятного фазового состава, включающего биоинертные металлооксидные соединения. Поэтому целью работы являлось исследование основных физико-химических и механических характеристик оксидных покрытий, формируемых на титановых имплантатах, а также разработка технологии изготовления анодированных имплантатов с качествами биосовместимости.
Методика исследований
Для получения комплекса функциональных характеристик оксидных покрытий
и требуемых показателей биосовместимости были проведены экспериментальные
исследования по анодированию костных титановых (ВТ1-00) имплантатов в
сернокислом электролите, представляющем водный раствор серной кислоты с
добавлением сульфата меди при концентрации компонентов 200 г/л Н2SO4 и 50
г/л CuSO4 · 5 Н2О.
Добавка в электролит сульфата CuSO4
обеспечивала повышение скорости роста толщины оксидного покрытия за счет
активирующего действия ионов Cu на
титановый анод [4]. Процесс оксидирования осуществлялся в стандартной
электрохимической термостатируемой ячейке с полым кольцевым титановым катодом и
насыщенным в
растворе КСl хлорсеребряным электродом сравнения (н.х.с.э.) при значениях анодной плотности тока 1-3 А/дм2,
температуре электролита 25-50оС и продолжительности электролиза
20-50 мин. Постоянство заданной температуры электролита поддерживалось с помощью
термостата типа МLW, а
процесс анодирования реализовывался при использовании источника
постоянного тока Б5-47.
Предварительно имплантаты подвергались пескоструйной обработке корундовым
абразивом на установке «Чайка-20» и ультразвуковому обезжириванию в моющем
растворе 40 г/л Na3РО4 для создания исходного выраженного
микрорельефа поверхности и ее очистки от жировых загрязнений, ухудшающих
смачиваемость электролитом.
Функциональные характеристики полученных оксидных покрытий определялись с использованием известных методов экспериментального исследования, а именно, рентгенофазового анализа, профилометрии, потенциометрии, микрометрии, количественной адгезиометрии, определения микротвердости, оптической микроскопии.
Фазовый состав покрытий устанавливался методом рентгенофазового анализа с помощью дифрактометра ДРОН-4, снабженного рентгеновской трубкой с медным анодом, в CuKα-излучении при сканировании брэгговского угла со скоростью 2 град/мин.
Толщина получаемых покрытий определялась с помощью оптической микроскопии на специально приготовленных микрошлифах по стандартной методике. Измерения проводили с использованием микроскопа МИМ-7, имеющего окуляр с размерной микрометрической шкалой, при увеличении 190 крат.
Шероховатость поверхности изделий исследовалась
профилометрическим методом измерения (ГОСТ 2789-73) параметров микронеровностей
Rа (среднеарифметическое отклонение профиля), Rz
(высота неровностей профиля по десяти точкам),
Rmax (наибольшая высота неровностей профиля), Rр
(среднеквадратичное отклонение профиля), Sm (средний шаг неровностей профиля) по
шестидесяти базовым линиям. Оборудованием
для определения шероховатости служил микропроцессорный профилограф-профилометр
«Калибр-117071».
Морфология оксидных покрытий исследовались
методом бесконтактного определения размерных параметров выступающих частиц и
имеющихся углублений, включая поры. Для таких измерений и обработки их
результатов использовался анализатор изображений микроструктур АГПМ-6М с
микроскопом «Биолам». Оптический анализ
морфологии поверхности анодированных образцов осуществлялся с использованием
микроскопов ММУ-7 и МИМ-7.
Коррозионная стойкость анодированного титана оценивалась по величине его
электродного потенциала Ес (н.х.с.э) в физиологическом
растворе 0,9% NaCl с рН=7,4, отвечающем химическому составу плазмы
крови и моделирующем условия функционирования имплантатов в жидких биосредах
организма.
Адгезионная
прочность (σадг) покрытий исследовалась методом нормального отрыва
с помощью разрывной машины ИР-5046-5.
Микротвердость (Нкв) оксидного покрытия измерялась по ГОСТ 9450-76 с помощью прибора ПМТ-3.
Результаты
исследования и их анализ
Фазовый состав анодно-оксидных покрытий характеризовался, в основном, биоинертными
оксидами титана нестехиометрического состава TiO2-х при х<<1 с небольшим
содержанием TiO, Ti2O3 и СuО. Последняя фаза является
следствием присутствия в сернокислом электролите катионов Cu2+ в результате чего при
электролизе происходит образование примесного оксида СuО и включение небольшого
количества его частиц в состав титанооксидного покрытия. Таким образом, сернокислотное анодирование
титана позволяет получить покрытие, состоящее из биоинертных оксидов, определяющих
совместимость оксидированных имплантатов с окружающими биоструктурами.
Толщина покрытий достигала приемлемых для эффективной биоинтеграции и механической
совместимости значений, находящихся на уровне 30-50 мкм, при анодной плотности
тока 2-3 А/дм2 и продолжительности около 1 ч. При этом было отмечено
незначительное влияние температуры электролита на интенсивность роста толщины
покрытия.
Шероховатость поверхности анодных покрытий титана при наибольших значениях режима
электролиза характеризовалась параметрами микронеровностей Ra=1,35 мкм, Rz=2,80 мкм, Rmax=6,20 мкм, Sm=10,20 мкм, обусловливающими
высокую структурную гетерогенность микрорельефа поверхности. В этих условиях
может происходить эффективное физико-механическое взаимодействие оксидированного
имплантата с костными структурами и повышаться надежность его закрепления в
организме.
На данном основании можно считать, что для получения шероховатых оксидных покрытий имплантатов с приемлемой для биоинтеграции толщиной необходимо осуществлять электролиз при повышенных значениях анодного тока и продолжительности обработки.
Морфология покрытий отличалась более
высокой степенью открытой пористости П, равномерностью распределения пор по
поверхности и наибольшими размерами структурных элементов при повышенных
значениях режима оксидирования, составляющих i=3 А/дм2, t=50оC, τ=0,9 ч (рис.1).
Такая морфология может обеспечить благоприятные условия для протекания
биоинтеграционных процессов имплантата, а именно, для равномерного и глубокого
прорастания костной ткани в поверхностную структуру покрытия.

Рис.1.
Поверхность оксидного покрытия, полученного анодированием
пескоструйно-обработанного титана в сернокислом электролите при различной плотности тока и t=50оС, τ=0,9 ч: а – i=1 А/дм2; б – i=2 А/дм2; в – i=3 А/дм2 (х300)
Коррозионный потенциал. Оценка потенциометрических измерений зависимости сдвига потенциала от анодной плотности тока, температуры электролита и продолжительности анодирования показывает, что средняя величина потенциала поверхности оксидных покрытий в модельном физиологическом растворе равна 0,15 В. Данная положительная величина потенциала Ес характеризует высокую электрохимическую устойчивость анодированных титановых имплантатов к коррозионному действию жидких биосред и свидетельствует о повышенной биосовместимости анодно-оксидных покрытий.
Адгезия и микротвердость сформированных покрытий соответствовали уровню σадг = 26-29 МПа и Нкв = 7-10 ГПа соответственно, что говорит о способности таких покрытий выдерживать значительные механические нагрузки, передаваемые на имплантат от костной ткани.
На основе проведенного анализа показателей функциональных характеристик полученных оксидных покрытий определены режимы сернокислотного анодирования титановых имплантатов, позволяющие создать морфологически гетерогенные, механически прочные и коррозионностойкие титанооксиды, совместимые с биоструктурами (табл.).
Таблица
Рекомендуемый технологический режим анодирования
титановых
имплантатов и характеристики оксидных покрытий
|
Электролит, г/л |
Режим электролиза |
Характеристики покрытий |
||||||||||
|
i, А/дм2 |
t, 0С |
τ, ч |
фазовый состав |
толщина, мкм |
адгезия, МПа |
микротвердость, ГПа |
пористость, % |
коррозионный потенциал, В (н.х.с.э) |
Параметры шероховатости, мкм |
|||
|
Rа |
Rmax |
Sm |
||||||||||
|
(200) H2SO4 и (50) CuSO4· 5Н2О |
3 |
40-50 |
0,9 |
TiO, TiO2, Ti2O3,
CuO |
30-50 |
29 |
10 |
30-35 |
0,15 |
1,35 |
6,20 |
10 |
Технологические рекомендации
по анодному формированию
оксидных покрытий на
титановых имплантатах
Исходя из
результатов исследования функциональных характеристик полученных анодно-оксидных
покрытий разработана технология изготовления анодированных медицинских
имплантатов, включающая процессы формообразования металлических основ, операции
подготовки их поверхности перед созданием покрытия, электролиз при установленном
режиме, окончательную обработку и контроль качества покрытия (рис.2).
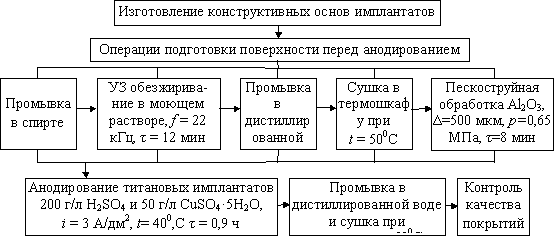
Рис.2. Технологическая схема изготовления
имплантатов из титана с анодно-оксидными биосовместимыми покрытиями
Изготовление
металлических основ имплантатов различного габарита, имеющих форму пластин,
спиц, гладких и резьбовых стержней в зависимости от костной патологии и
требований к выполняемым функциям производится с помощью механической и электрофизической
обработки.
Подготовка поверхности выполняется за счет ультразвукового обезжиривания
имплантатов в специальных моющих растворах для удаления жировых пленок, что
характеризуется уровнем остаточных загрязнений, составляющем не более 10-9
г/см2. Промывкой обезжиренной поверхности в дистиллированной воде
обеспечивается удаление компонентов моющего раствора. Пескоструйной обработкой
создаются исходная микрошероховатость и морфологическая гетерогенность
поверхности, а также ее химическая активация, чем повышается эффективность
условий окисления имплантатов и достигаются необходимые параметры структурного
состояния оксидного покрытия, его высокая адгезия.
Анодированием пескоструйно-обработанных титановых основ в сернокислом
электролите с добавлением CuSO4 при установленном режиме
электролиза формируется покрытие с требуемыми качествами биосовместимости. Последующими
промывкой и сушкой из пор покрытия удаляются компоненты сернокислого
электролита и влага (рис.2).
Технологические
рекомендации включают особенности подготовки поверхности имплантатов перед
формированием покрытий, выбор целесообразных условий и режима проведения
электролиза, контроль качества покрытий и требования к техническому обслуживанию
электрохимического оборудования (электролизера).
Подготовку
поверхности путем пескоструйной обработки необходимо осуществлять при
избыточном давлении воздушно-абразивной струи не менее 0,65 МПа, используя корундовый
абразив дисперсностью 300-500 мкм и производя обдувку на дистанции 80-160 мм
под разными углами обработки в течение 8-10 мин. Эти условия позволяют сформировать
развитый гетерогенный микрорельеф поверхности титана, активировать приповерхностные
слои металла и обеспечить его очистку от механических загрязнений. Перечисленные
особенности способствуют усилению процесса окисления, созданию титанооксидного
покрытия с высокими значениями адгезии, открытой пористости, степени шероховатости
и параметров морфологии, необходимыми для его эффективного взаимодействия с костными
структурами и прочного закрепления имплантата в биоткани.
Ультразвуковое обезжиривание целесообразно проводить в водном растворе
тринатрийфосфата Na3РО4, концентрацией 40 г/л, при
интенсивности ультразвуковых колебаний W=1,2 Вт/см2, частоте f=22 кГц и продолжительности
25-30 мин. Эти условия позволяют обеспечить эффективное обезжиривание
поверхности, улучшить ее смачиваемость электролитом и повысить стабильность
электрохимической обработки.
Для создания необходимых физико-химических и механических свойств
оксидных покрытий анодную обработку титановых имплантатов целесообразно
проводить в сернокислом электролите с добавкой СuSO4, интенсифицирующей
окисление с ускорением роста толщины покрытия и снижением продолжительности
оксидирования. Кроме того, образующаяся фаза CuO в составе титанооксидного
покрытия и присутствие в нем ионов меди обеспечивают антисептическое
воздействие на окружающие биоткани и благоприятно влияют на протекание
нормального раневого процесса при адаптации имплантата.
По окончании обработки имплантаты следует тщательно промыть в дистиллированной
воде в течение 5-7 мин для удаления компонентов электролитов из пор покрытия,
так как остатки электролитов могут вызвать раздражение и воспаление прилегающих
к имплантату биотканей и создать риск его отторжения. При этом необходимо
сократить до минимума время между окончанием электролиза и промывкой
имплантатов, чтобы уменьшить растравливающее действие сернокислого электролита.
После промывки оксидированные имплантаты нужно просушить в термошкафу при
температуре 50оС до полного испарения влаги с поверхности покрытия.
Контроль качества получаемых анодно-оксидных покрытий осуществляется
визуально, с помощью оптической микроскопии, микрометрии. При этом оценивается
уровень поверхностно-структурной однородности покрытий, характер распределения
морфологических элементов, определяются наличие трещин и участков разрушений, а
также толщина оксидного слоя.
После завершения
обработки имплантатов из электролизера сливается использованный электролит,
производится промывка рабочей полости и противоэлектрода дистиллированной
водой. Для анодирования следующей партии имплантатов целесообразно использовать
новый раствор электролита, так как он обладает исходной химической однородностью
и требуемыми свойствами. По мере накопления твердых осадков на дне и стенках
электролизера, а также на поверхности противоэлектрода, их следует регулярно удалять.
Выводы
Выполнены
исследования по формированию оксидных покрытий на медицинских титановых
имплантатах методом анодирования. При этом:
- установлено, что в сернокислом электролите, концентрацией 200 г/л Н2SO4 и 50 г/л CuSO4 · 5 Н2О, при показателях режима i=3 А/дм2, t=40-50оС и τ=0,9 ч получаются анодно-оксидные покрытия, обладающие биосовместимостью;
- разработана схема
технологического маршрута изготовления анодированных имплантатов;
- даны расширенные
рекомендации по созданию биосовместимых оксидных покрытий на титановых
имплантатах для стоматологии, травматологии и ортопедии.
Литература
1. Родионов И.В. Создание электрохимических биосовместимых покрытий на основе диоксида TiO2 методом анодирования титана и его сплавов / Сб. трудов XVI Междунар. научно-практ. конф. студентов, аспирантов и молодых ученых «Современные техника и технологии». Томск: Изд-во ТПУ, 2010. Т.2. С. 71-73.
2. Родионов И.В., Бутовский К.Г. Функциональные свойства анодно-оксидных биосовместимых покрытий титановых дентальных имплантатов / Материалы междунар. науч. конф. «Химия, химическая технология и биотехнология на рубеже тысячелетий». Томск. Изд-во ТПУ, 2006, Т.2. С. 424-426.
3. Родионов И.В. Анодно-оксидные биосовместимые покрытия титановых дентальных имплантатов // Технологии живых систем. Т.3, №4, 2006. С. 28-32.
4. Родионов И.В., Попова С.С. Функциональные свойства
анодно-оксидных покрытий, формируемых на титановых имплантатах в растворе серной
кислоты с добавкой сульфата меди // Гальванотехника и обработка поверхности.
Т.18. №4, 2010. С. 35-43.