Ветеринария / 1. Ветеринарная
медицина
асп. Ткаченко Е.А., д.б.н. Дерхо М.А.
Уральская государственная академия
ветеринарной медицины, Россия
ХАРАКТЕРИТИКА
эозинофилИИ при
ЭКСПЕРИМЕНТАЛЬНОЙ
КАДМИЕВОЙ ИНТОКСиКАЦИИ
Эозинофилы представляют собой клетки, состоящие
из двусегментного ядра, мембраны и цитоплазмы, образуются в костном мозге.. Продолжительность
жизни эозинофилов сравнительно невелика и составляет 10–12 дней. Покинув костный
мозг, где они образуются и созревают в течение 3–4 дней, эозинофилы несколько
часов циркулируют в крови (период их полужизни в ней составляет 6–12 ч). Затем,
подобно нейтрофилам, они покидают кровяное русло и уходят в периваскулярные
ткани, главным образом в легкие, желудочно-кишечный тракт и кожу, где и проводят
остаток своей жизни [4, 7]. В современной литературе эозинофильный гранулоцит
принято рассматривать не только в качестве активного участника развития
аллергических заболеваний и противогельминтного иммунитета, но и как важный
фактор поддержания тканевого и иммунологического гомеостаза. Эозинофилы
обладают способностью секретировать широкий спектр биологически активных
веществ, экспрессировать на своей поверхности разнообразные рецепторы и
адгезивные молекулы [3, 5].
В норме в мазке крови эозинофилы
составляют до 5% лейкоцитов. Увеличение уровня эозинофилов называется эозинофилией;
различают умеренную эозинофилию - при наличии 10-15 % клеток в периферической
крови; выраженную - если их количество превышает 15 %, а состояния, при которых
количество эозинофилов больше 15-20 %, предложено называть «большими эозинофилиями
крови» [3]. Многие заболевания и состояния протекают с эозинофилией: гельминтозы,
аллергозы непаразитарной природы; неопластические процессы и т.д.
Представления
об участии эозинофилов в противотоксической защите организма животных по
сравнению с другими клетками системы иммунитета при экспериментальных
токсикозах существенно ограничены.
В связи с этим целью настоящей работы
явилось исследование особенностей характера изменчивости уровня и морфологии эозинофильных
гранулоцитов при экспериментальной кадмиевой интоксикации, сопровождающейся синдромом
эозинофилии.
Материалы
и методы исследования. Объектом
исследования служили половозрелые самцы белых лабораторных мышей с массой тела 25-30
г. Опытная группа состояла из 60 особей. Животные находились на стандартном пищевом
рационе, имели свободный доступ к воде
и корму. Кадмиевый токсикоз вызывали путем ежедневного введения CuSO4
per os в дозе
40 мг/на голову (21,5 мг Cd2+ на голову). Материал исследований (кровь) получали
после декапитации мышей, которую проводили под наркозом эфира с хлороформом с соблюдением
принципов гуманности, изложенных в директивах Европейского сообщества
(86/609/ЕЕС) и Хельсинкской декларации, до интоксикации, через 1, 3, 7 и 15-ые
сутки интоксикации.
Мазки крови изготавливали сразу после
взятия материала, затем окрашивали по методу Романовского-Гимзы. Подсчет
лейкоцитов проводили в камере Горяева, оценку морфологии лейкоцитов - с помощью иммерсионного объектива. На
основании полученных данных рассчитывали следующие индексы: 1) эозинофильный индекс:
![]() ; 2. Индекс аллергизаци:
; 2. Индекс аллергизаци: ![]() ; 3) индекс соотношения лимфоцитов и эозинофилов:
; 3) индекс соотношения лимфоцитов и эозинофилов: 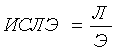 , где ПН, СН, Э, Л, М – относительное содержание палочкоядерных
нейтрофилов, сегментоядерных нейтрофилов, эозинофилов, лимфоцитов, моноцитов (%).
, где ПН, СН, Э, Л, М – относительное содержание палочкоядерных
нейтрофилов, сегментоядерных нейтрофилов, эозинофилов, лимфоцитов, моноцитов (%).
Статистическую обработку данных проводили
методом вариационной статистики на ПК с помощью табличного процессор «Microsoft
Excеl – 2003» и пакета прикладной программы «Биометрия». Достоверность различий
между группами оценивали с учетом непараметрического критерия Манна-Уитни.
Результаты исследований. При оценке количественных
показателей белой крови у мышей в ходе кадмиевой интоксикации выявлялось
существенное увеличение относительного количества эозинофилов в крови по сравнению с аналогичными параметрами до интоксикации
(табл.). При этом в первые трое суток токсикоза их уровень составил 18,10±0,37
- 18,80±0,49%. Следовательно, в организме мышей на фоне введения ионов кадмия
развивается токсическая гиперэозинофилия. Она обусловлена
аллергическим характером влияния металла. При этом сульфат кадмия, как
экзогенный аллерген сам по себе, конечно, не является антигеном, а только
фактором, вызывающим их появление [2]. Он индуцирует образование аллергенов из
биомолекул организма за счёт их химической денатурации, что инициирует развитие
аллергических реакций замедленного типа.
Период токсической гиперэозинофилии
сопровождался изменением морфологии лейкоцитов эозинофильного ряда: клетки
увеличивались в размере, имели повышенную вакуолизацию ядра и цитоплазмы. Данные
характеристики эозинофилов были установлены в 80% мазков крови.
Известно, что между
клетками иммунной системы существует определенная взаимосвязь в проявлении их
действия. Так, эффекты эозинофилов обусловлены, с одной стороны,
иммунорегулирующим действием лимфоцитов, что определяет эозинофилы как эффекторное
звено иммунных реакций, а с другой — способностью эозинофильных гранулоцитов
синтезировать широкий спектр медиаторов, что указывает на их иммуномодулирующую
функцию [3]. Для оценки влияния уровня
лимфоцитов в крови мышей на содержание эозинофилов мы рассчитали индекс соотношения лимфоцитов и эозинофилов (ИСЛЭ). Величина
ИСЛЭ в период токсической гиперэозинофилии уменьшалась в 3,8-4,1 раза (р>0,001)
(табл.), что было следствием резкого увеличения уровня эозинофильных гранулоцитов
на фоне сохранения лимфоцитов и свидетельствовало о дизрегуляции эффектов между данными клетками крови. Вероятно, это было обусловлено,
во-первых, нарушением процессов созревания, дифференцировки и активации
эозинофилов, что приводило к длительному пребыванию последних в периферической крови;
во-вторых, сокращением времени генерации эозинофильных лейкоцитов и, в-третьих,
возвращением их в кровоток из тканей.
Таблица – Индексы эозинофилов (n=10), Х±Sx
|
Показатель |
До интоксикации |
Продолжительность кадмиевой интоксикации, сут |
||||||
| 1 |
3 |
7 |
15 |
|||||
|
Эозинофилы, % |
5,00± 0,14 |
18,80± 0,49*** |
18,10± 0,37*** |
10,60± 0,49*** |
10,40± 0,16*** |
|||
|
Лимфоциты, % |
75,60± 0,22 |
69,80± 0,85*** |
70,10± 0,52*** |
71,20± 0,41 |
64,40± 0,40*** |
|||
|
ЭИ, усл. ед. |
0,52± 0,01 |
0,32± 0,009*** |
0,27± 0,02*** |
0,20± 0,03*** |
0,36± 0,01*** |
|||
|
ИА, усл. ед |
6,45± 0,96 |
22,73± 0,26*** |
21,14± 0,59*** |
9,53± 0,25*** |
6,56± 0,08 |
|||
|
ИСЛЭ,
усл. ед. |
15,25± 0,46 |
3,74± 0,13*** |
3,97± 0,31*** |
6,95± 0,97*** |
6,20± 0,07*** |
|||
Примечание: * - р<0,001
по сравнению с величинами «до интоксикации»
Одно из основных функций
эозинофилов является участие в реакциях гиперчувствительности (о чем говорилось
выше), в ходе которых они фагоцитируют гранулы тучных клеток, инактивируют гистамин,
хемотаксические пептиды и гепарин [4], а после завершения способствуют репарации
тучных клеток [6]. Установлено, что при
реакциях гиперчувствительности замедленного типа хотя и происходит накопление эозинофилов
в крови, но оно не сопровождается
активными клеточными реакциями с их стороны [1].
Для того чтобы оценить
функциональную активность эозинофилов в ходе экспериментального кадмиевого
токсикоза мы рассчитали индекс аллеризации. Значение ИА дает представление о
выраженности антигенного действия ионов кадмия на организм мышей и степени
активности факторов иммунной защиты.
Период токсической
гиперэозинофилии (первые трое суток токсикоза) сопровождался увеличением величины ИА в 3,27-3,52 раза (р<0,001). Следовательно,
эозинофилия – это есть выраженность меры ограничения иммунного ответа в
организме мышей на фоне поступления кадмия, являющегося результатом резкого
снижения относительного содержания нейтрофилов в крови. Для того чтобы
проверить данное предположение мы рассчитали эозинофильный индекс, величина
которого отражает взаимообусловленность эффектов и концентраций нейтрофилов и эозинофилов в крови.
Значение ЭИ в ходе экспериментального
токсикоза уменьшалось в 1,62-2,6 раза (р<0,001) (табл.). Значит, эозинофилия является результатом
недостаточной активности фагоцитарных процессов в организме мышей.
Таким образом, эозинофилы и гиперэозинофилия
при экспериментальной кадмиевой интоксикации является
маркером степени токсического действия кадмия на клетки организма мышей и
функциональной активности факторов специфического и неспецифического
иммунитета.
Литература
1.
Сорока, Н.Ф. Современные представления о роли
эозинофолов в организме и гиперэозинофильных синдромах / Н.Ф. Сорока, М.А.
Савченко // Медицинские новости. – 1995. - № 3. – С. 17-29.
2. Степанова, Н.А. Нарушения иммунологической
реактивности (патофизиологические аспекты): Учеб.-метод. пособие / Н.А.
Степанова, Ф.И. Висмонт. – Минск: БГМУ, 2010. – 44 с.
3. Цитотоксический
потенциал эозинофильных гранулоцитов у больных с синдромом эозинофилии / Л.С.
Литвинова [и др.] //Бюллетень сибирской медицины. – 2006. - № 3. – С. 26-31.
4.
Эозинофилия / Н.Т. Ватутин [и др.] // Університетська клініка. – 2012. - Т. 8. - № 1. – С. 67-72.
5. Andersen, C. .Eosinophilia
– pathogenesis, classification and therapy / С. Andersen, Н. Vestergaard, Р. Norgaard // Ugeskr Laeger. – 2009. – Vol. 171. – P.
- 3256-3262.
6. Cortes J., Ault P., Koller
C. et al. Efficacy of imatinib mesylate in the treatment of idiopathic hypereosinophilic
syndrome / J. Cortes, P. Ault, C.
Koller // Blood. - 2003. – Vol. 101. – P. 4714-4716.
7. Gotlib J. World Health
Organization-defined eosinophilic disorders: 2011 update on diagnosis, risk
stratification, and management / J. Gotlib // Am. J. Hematol. – 2011. – Vol.
86. – P. 677-688.