д.мед.н. Венцківська І.Б.,
Прощенко О.М.,
Національний медичний
університет імені О.О. Богомольця, кафедра акушерства і гінекології №1
Вплив генетичних предикторів на генез
репродуктивних втрат
В
даний час питання невиношування вагітності (НВ) має статус одного з найбільш
пріоритетних напрямків акушерства у зв'язку зі стабільно високою частотою у
популяції і значною поширеністю несприятливих наслідків вагітності для матері
та новонародженого. Частота НВ коливається від 10 до 25%. У більшості випадків,
коли репродуктивні втрати на ранніх термінах вагітності мають рекурентний
характер, представляється можливим припустити наявність постійних факторів -
генетично детермінованих. НВ розглядають при цьому як мультифакторіальне
захворювання - результат адитивної дії багатьох генів і зовнішніх факторів [1].
За сучасними даними, частка спадкових тромбофілій в структурі причин НВ
становить 30-55%. Серед яких основними вважають поліморфізм генів ферментів
фолатного циклу (5,10-метилентетрагідрофолатредуктаза MTHFR C677T); згортання
крові (мутація генів протромбіну FII G20210А, фактора V FV (Leiden) G1691A);
системи фібринолізу (поліморфізм гена інгібітора активатора плазміногену 1
PAI-1675 5G / 4G) [2, 3]. Стрімкий розвиток молекулярної генетики дозволив
виділити генетично обумовлені форми тромбофілії в групу самостійних причин
репродуктивних втрат. В даний час вивчення генетичних предикторів на процеси
імплантації, інвазії трофобласта, подальше функціонування плаценти і перебіг
вагітності набувають особливої актуальності і потребують подальшого
дослідження.
Мета
дослідження. Зниження частоти невиношування вагітності шляхом прогнозування
впливу генетичних предикторів.
В
рамках проведеного дослідження було обстежено 280 жінок, з них 256 з НБ, з
числа яких у 84 пацієнток з самовільним викиднем (32,8%) було виявлено
наявність спадкової мутації: вони склали основну групу обстежених жінок.
Контрольну групу склали 37 вагітних жінок з фізіологічним перебігом вагітності.
Всі жінки проходили молекулярно-генетичне тестування мутації генів MTHFR С677Т,
FV (Leiden) G1691A, FII G20210A і PAI-1675 5G/4G. Дослідження генетичного
поліморфізму проводилося з використанням методу алель-специфічної полімеразної
ланцюгової реакції. Аналіз розподілу генотипів досліджуваних SNP проводився за
допомогою тесту хі-квадрат, а також точного критерію Фішера. З метою ранжування
предикторів за значимістю їх впливу і можливої асоціації з ризиком розвитку НВ
використовувалися два непараметричних методи, а саме: метод випадкового лісу
[4] і метод багатофакторного зменшення розмірності [5] для визначення міжгенної
взаємодії. Статистично значущими результатами вважалися ті, які досягли рівня
статистичної значущості р <0.05. Аналіз даних був проведений в середовищі для
статистичних розрахунків R (ver. 3.0), а також з використанням Statistical
Package for Social Science program (SPSS for Windows, version 21.0, SPSSInc.,
Chicago, IL.).
Отримані
результати проведеного молекулярно-генетичного тестування показали, що мутація
MTHFR С677Т виявлена в 32 жінок (38,1%), поліморфізм гена PAI-1675 5G/4G в 16
(19,0%), FV (Leiden) G1681A в 7 (8,3%), FII G20210A в 1 (1,2%) і комбінації
мутацій у 28 (33,3%). Для виявлення можливих асоціацій поліморфізмів генів з НВ
нами був проведений порівняльний аналіз частот алелей і генотипів між
пацієнтками з невиношуванням вагітності та контрольною групою, який показав
наступні статистично значущі відмінності. Частота гетерозиготний генотипу
мутації гена MTHFR C677T (51,2%) у жінок основної групи зустрічалась частіше в
порівнянні з контрольною групою (13,5%), а частка гомозиготних носіїв мутації
гена MTHFR C677T (15, 4%) була в три рази більше показника контрольної групи
(5,4%). Аналіз мутації гена PAI-1 675 5G/4G в групі жінок з НВ показав зниження
частки нормального генотипу 5G/5G (54,8%) у порівнянні з контрольною групою
(75,7%, р <0,05). У той же час частка гетеро- і гомозиготних носіїв
генотипів була вище в порівнянні з контрольною групою (25,0% і 20,2%, проти
18,9% і 5,4%). У групі жінок з НВ виявлено високу частоту гетеро- і
гомозиготної мутації FV (Leiden) G1691A (12,8%, 2,6%) порівняно з даними
контрольної групи (2,7%, 0%).
У параметрах побудови для методу випадкового лісу
було вказано 1000 дерев, з можливістю вибору 2 випадкових предикторів для
створення кожного з вузлів класифікації. За допомогою даного методу вдалося
виявити два статистично значущих предиктора, які асоціюються з ризиком розвитку
захворювання - MTHFR C677T і FV G1691A, причому поліморфізм MTHFR C677T надає найбільше значення серед усіх вивчених
поліморфізмів. Ранжування приведено на рис.1
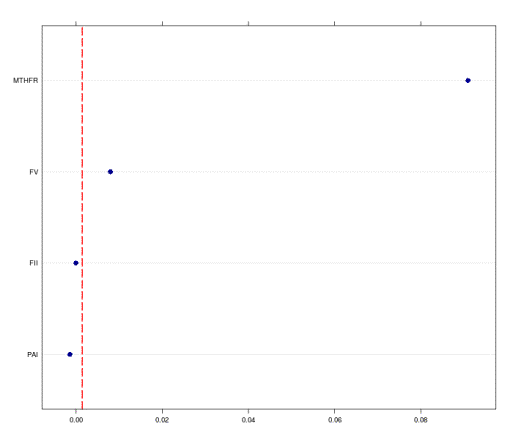
Рисунок
1 Ранжування поліморфізмів генів MTHFR С677Т, FV (Leiden) G1691A, FII G20210A і
PAI-1675 5G / 4G
Відсоток
правильної класифікації для навчальної вибірки склав 75%, а для тестуючої - 73%
відповідно.
Метод
багатофакторного зменшення розмірності був застосований з метою визначення типу
зв'язку між поліморфізмом, а також аналізу комбінацій генотипів, які
асоціюються з ризиком розвитку невиношування вагітності. Метод багатофакторного
зменшення розмірності був застосований з стандартними налаштуваннями і
установкою значення крос-перевірочного параметра рівним 10. За допомогою даного
методу була отримана модель, яка також містила 2 поліморфізми, а саме: MTHFR
C677T і FV G1691A. Прогностична цінність такої моделі склала 73% на тестуючій
вибірці з крос-перевірочним значенням рівним 9/10. Нам вдалося встановити, що
між поліморфізмом MTHFR C677T і FV G1691A відсутня синергічна взаємодія, що
відображено на рис. 2.
![]()
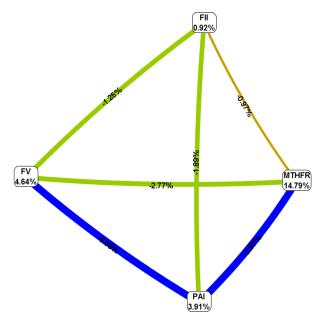
Рисунок
2 Взаємодії між поліморфізмами генів MTHFR С677Т, FV (Leiden) G1691A, FII
G20210A і PAI-1675 5G / 4G
Примітка:
стрілкою відображені головні незалежні ефекти
Комбінації
генотипів, які асоціюються з ризиком розвитку невиношування вагітності наведено
на рис. 3. Комбінації як гомо-, так і гетерозиготних генотипів генів MTHFR
С677Т, FV (Leiden) G1691A асоціюються з ризиком розвитку репродуктивних втрат.
Розрахований коефіцієнт співвідношення шансів показав підвищення ризику
повторних викиднів у 8 разів у жінок - носіїв мутації генів MTHFR С677Т С/T і
FV (Leiden) G1691A G/G, 9 разів при поліморфізмі MTHFR С677Т Т/T і FV (Leiden)
G1691A G/А.
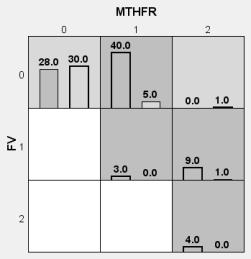
Рисунок
3 Комбінації генотипів MTHFR С677Т, FV (Leiden) G1691A, які асоціюються з ризиком
розвитку невиношування вагітності
Примітка:
темно-сіра клітинка - комбінація, яка асоційована з НВ
1 -
гетерозиготний генотип
2 -
гомозиготний генотип
Таким чином застосувавши комбінацію методів випадкового лісу і
багатофакторного зменшення розмірності, нам вдалося визначити найбільш важливі
предиктори, які асоціюються з ризиком розвитку НВ. Була створена модель з
класифікаційної цінністю 73%, яка складається з 2 найбільш впливових і
статистично значущих предикторів - поліморфізмів MTHFR C677T і FV G1691A. Було
визначено, що поліморфізми MTHFR C677T і FV G1691A представляють головні
незалежні ефекти, а також виявлені комбінації генотипів, які асоціюються з
ризиком розвитку НВ. Тому молекулярно-генетичне обстеження на спадкову
тромбофілію ми вважаємо обов'язковим в алгоритмі обстеження жінок з НВ.
Своєчасне виявлення генетичних предикторов тромбофілії у жінок з НВ дозволить
оптимізувати преконцепційну підготовку до наступної вагітності для зниження
ризику репродуктивних втрат та акушерських ускладнень і служить показанням до
посиленого клініко-лабораторному контролю гемостазу під час вагітності та при
необхідності проведення лікувальних заходів.
Список літератури
1.
Беспалова О. Н. (2007) Генетика невынашивания
беременности Журн. акушерства и жен.
болезней. N 1. – p. 81–95.
2.
Bura-Rivière A. (2012) Thrombophilia and
pregnancy. Rev. Prat. Vol. 62, N 7. –
P. 937–942.
3.
Макацария А. Д. Бицадзе В. О., Акиньшина С. В. (2007) Тромбозы и тромбоэмболии в акушерско-гинекологической клинике.
Молекулярно-генетические механизмы и стратегия профилактики тромбоэмболических
осложнений руководство для врачей– М. : МИА, P 1059 c.
4.
Strobl
C, Boulesteix L, Kneib Т (2008) Conditional variable
importance for random forests. BMC
Bioinformatics. 9:307.
5.
Alison A, Ritchie
M, Marylyn D. (2006) Multifactor dimensionality reduction: An analysis
strategy for modelling and detecting gene – gene interactions in human genetics
and pharmacogenomics studies. Нuman genomics.
2:318–28.