Белорусский государственный университет
химический
факультет
кафедра
аналитической химии
Сорбция алкилрезорциновым пенопластом
катионов щелочных и щелочно-земельных металлов.
Мечковский
С.А., Радкевич Т.И.
Исследование
протолитических свойств ионообменников на основе многоатомных фенолов, фенола и
формальдегида является на данный момент актуальной задачей. Представляют
интерес ионообменные свойства алкилрезорцинового пенопласта (АРП), возможность
использовать его для селективного извлечения радиоактивных 137Сs и 90Sr из щелочных растворов. Данный
сорбент удовлетворяет ряду требований: высокая обменная емкость, большая
скорость ионного обмена, химическая устойчивость по отношению к кислотам и
щелочам, нерастворимость в воде, растворах электролитов и органических
растворителях.
Одной
из первостепенных задач экологического мониторинга объектов окружающей среды является
исследование концентрационной зависимости сорбции радионуклидов в природной
среде. При исследовании кислотно-основного равновесия и диссоциации
полиэлектролитов природного и синтетического происхождения эффективным и
информативным методом является рК-спектроскопия. Преимущество охвата широкого
интервала рН, варьирование электролитного фона, выявление особенностей гетерофазного
контакта «сорбент – водный раствор» – такие возможности открывают кривые
титрования с последующим применением бренстедовской рК-спектроскопии. Данный
метод особенно полезен при изучении природных и искусственных полиэлектролитов,
содержащих энергетически неоднородные функциональные группы. В этом случае
рК-спектроскопия наиболее адекватно отражает свойства системы.
На
кислотно-основные свойства полиэлектролитов влияют концентрация поперечных
связей в сетчатом ионообменнике, конформационные переходы цепей в процессе
связывания, плотность заряда на поверхности и на ионе, степень координационной
ненасыщенности комлексообразователя. Наряду с этим, одним из важнейших
факторов, определяющих свойства сорбента, является метод его синтеза,
модификации и обработки.
В данной работе показано влияние природы и
концентрации электролита на протолитические свойства алкилрезорцинового
пенопласта. Непосредственно из полученных методом потенциометрического
титрования данных следует изменение параметров нелинейности Грегора и значений
кажущихся констант диссоциации на широком интервале рН. Это свидетельствует о присутствии в сорбенте
функциональных групп, которые оказывают влияние на смещение электронной
плотности на резорциновых группах, тем самым усиливая
их кислотные свойства. Приведены параметры нелинейности Грегора в случаях
катионов щелочных и щелочно-земельных металлов, при
этом максимальные их значения соответствуют элементам пятого периода Rb и Sr.
Экспериментальная часть
Для описания протолитических свойств
полиэлектролита применяется уравнение Грегора: ![]() , где α – степень ионизации полиэлектролита, рК’
– кажущаяся константа ионизации. При этом возникает ряд осложнений, поскольку в
широком интервале рН угловые коэффициенты n изменяются.
, где α – степень ионизации полиэлектролита, рК’
– кажущаяся константа ионизации. При этом возникает ряд осложнений, поскольку в
широком интервале рН угловые коэффициенты n изменяются.
Нами
методом рН-метрического титрования была определена зависимость n от радиусов катионов металлов в системах АРП – водный
раствор Мz+Аz-
(Мz+ = Li+, Na+, K+, Rb+, Cs+, Ca2+, Sr2+, Ba2+; A- = Cl-, NO3-).
На
рисунках 1, 2, 3 представлены зависимости ![]() , из которых были определены константы диссоциации рК’
и n.
, из которых были определены константы диссоциации рК’
и n.
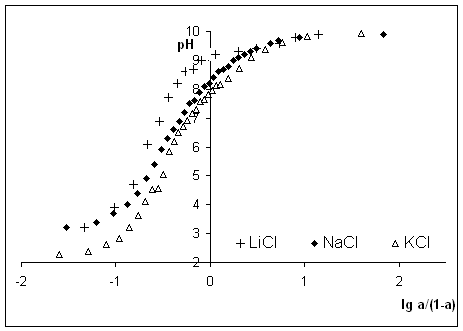
Рис.1.
Зависимость ![]() для алкилрезорцинового
пенопласта в растворах LiCl, NaCl,
KCl.
для алкилрезорцинового
пенопласта в растворах LiCl, NaCl,
KCl.
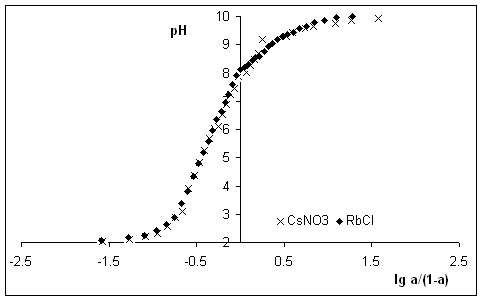
Рис. 2. Зависимость ![]() для алкилрезорцинового
пенопласта в растворах CsNO3,
RbCl.
для алкилрезорцинового
пенопласта в растворах CsNO3,
RbCl.
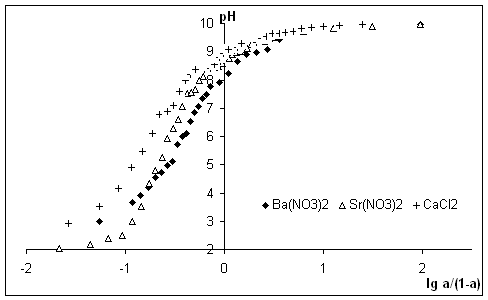
Рис. 3.
Зависимость ![]() для
алкилрезорцинового пенопласта в растворах Ba(NO3)2,
Sr(NO3)2, CaCl2.
для
алкилрезорцинового пенопласта в растворах Ba(NO3)2,
Sr(NO3)2, CaCl2.
Из
рисунков четко видно влияние природы действующих на данном интервале рН
функциональных групп на рК’ и n. Для синтетических и природных ионообменников линейной
зависимости, описываемой уравнением Грегора, не наблюдается, поскольку они не
обладают рядом идентичных функциональных групп, а
содержат разные по природе группы.
В
таблице 1 представлены параметры Грегора для различных систем.
Табл.
1. Параметры Грегора в интервалах рН 2-4, 4-8, 8-10.
|
Интервал
рН |
n
|
|||||||
|
Li+ |
Na+ |
K+ |
Rb+ |
Cs+ |
Ca2+ |
Sr2+ |
Ba2+ |
|
|
2¸4 |
2.82 |
1.21 |
0.87 |
0.50 |
0.46 |
2.41 |
0.76 |
2.19 |
|
4¸8 |
5.92 |
5.30 |
5.94 |
7.15 |
6.15 |
5.48 |
7.28 |
5.55 |
|
8¸10 |
0.71 |
0.30 |
0.33 |
0.88 |
0.60 |
0.25 |
0.39 |
0.09 |
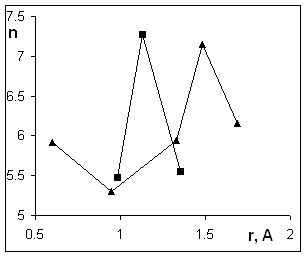
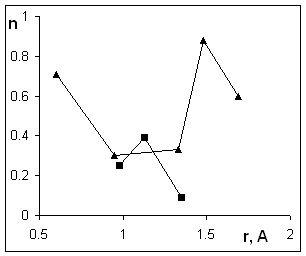
В
интервалах рН 4¸8, где
наклон максимален, и 8¸10
(интервал действия слабокислотных резорциновых групп), наблюдается одинаковый
ход зависимостей n от радиуса
катионов щелочных и щелочноземельных металлов (рис. 4, 5).