Дрижак А. С.,
Король Я. Д., Галаган Р. Л.
Черкаський національний університет ім. Богдана
Хмельницкого
Хімія гуматстабілізованих наночастинок срібла у водному розчині
Природні
та синтетичні гумінові речовини (гумінові кислоти, фульвокисоти та їх солі)
останнім часом знаходять застосування як відновники у процесах синтезу
наночастинок металів, зокрема, срібла. У роботі [1] описано синтез аналогів природних гумінових кислот виходячи з пірокатехіну та
уротропіну. Механізм процесу формування наночастинки, згідно з [2] включає
утворення іоном Ag+ комплексу з аніонною формою гумінової
речовини Hm y– (Hm – гумат-аніон):
Ag+
+ Hm y– ® [Ag Hm] z– ; z = y – 1.
Утворений комплекс діє як молекулярний гальванічний елемент, у якому катодна напівреакція – відновлення іонів Ag+ з розчину, відбувається на центральному атомі комплексу і веде до формування первинного металокластера. Анодний процес, згідно з [2], є реакцією окиснювального гідроксидування ароматичних ядер у складі гумінової речовини за Елбсом [3]. Кількість атомів Ag у первинному кластері буде визначатися відновлюючою здатністю органічного субстрату Hm:
2Ag+ + 3OH- + [AgHm]z– ®
[Ag3Hm(O)](z+1) – + 2H2O;
2Ag+ + 3OH- + [Ag3Hm(O)](z+1) – ® [Ag5Hm(O)2](z+2) – + 2H2O;
…..............................................................................................
2nAg+ + 3nOH- + [AgHm]z– ® [Ag(2n+1)Hm(O)n](z+n) – + 2nH2O.
У цих рівняннях символом Hm позначено таку субодиницю гумінової речовини, яка здатна утворити хелатний комплекс з одним йоном Ag+.
За даними рентгенівської дифракції розмір блоку когерентного розсіювання для наночастинок, виділених у тверду фазу, складає близько трьох нанометрів. Це означає, що цей блок складається не менше ніж з 500 атомів. Механізм процесу агрегування первинних кластерів, що приводить до формування кінцевої наночастинки залишається поки-що невідомим.
Оскільки, при виділенні наночастинок у тверду фазу, в неї переходить практично уся початково взята кількість Карбону гумінових чи фульвокислот, то логічно припустити, що частково окиснені гумати або фульвати є хемосорбованими на поверхні нанокристалу. При цьому позитивний заряд центральних атомів у частинках комплексу [Ag+Hm] z – обумовлюватиме позитивний заряд нанокристалу в цілому.
У лужному середовищі хемосорбовані молекули частково окиснених гумінових речовин матимуть значний негативний заряд за рахунок іонізації гідрокси- та карбоксигруп. Саме цей заряд і обумовлює агрегативну стійкість системи. Отже, нанокристал з хемосорбованими на його поверхні оксигуматами можна розглядати як макроаніон деякої кислоти, здатний реагувати з катіонами металів та Гідрогену.
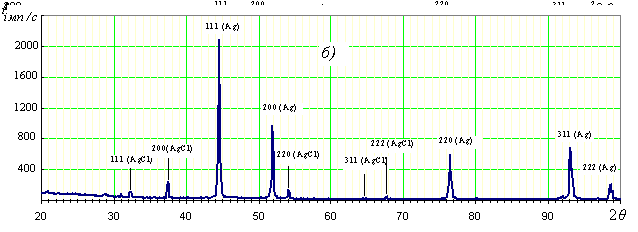
Реагенти, здатні зв’язувати катіони Ag+, наприклад хлорид-іони при їх загальній концентрації » 3 М, руйнують систему з виділенням сірого осаду. Ренгенографічне дослідження цього осаду (Рис. 1) показало наявність у ньому, поряд з металічним сріблом, фази AgCl, що доводить наявність у системі комплексно зв’язаних катіонів Ag+, які є проміжною ланкою між Ag-фазою нанокристалу і молекулами лігандів (Hm), що утворюють стабілізуючу оболонку. Взаємодія відбувається за рівнянням:
[Ag(2n+1)Hm(O)n](z+n) – + Cl– ® 2nAg¯ + AgCl¯ + [Hm(O)n](y+n) –.
Рис.1.
Дифрактограми нанокластерної системи (а) та продуктів
її
руйнування хлоридом (б)

У даній роботі ми досліджуємо стехіометричні відношення у
реакціях нанокластерів срібла, стабілізованих синтетичними гуматами, з
нітратною кислотою та катіоном Cu2+. Як прекурсор
для синтезу нанокластерів було використано синтетичну гумінову кислоту,
одержану за методикою, описаною в [1].
Схему будови нейтральної наночастинки подано на Рис.2. Молярну масу субодиниці
Hm прийнято рівною 200 г/моль.
Рис.2.
Схема будови нейтральної наночастинки срібла, виділеної у тверду фазу
Реакція з нітратною кислотою формально може розглядатися як протонування макроаніону на поверхні якого знаходяться іонізовані карбокси- та гідроксигрупи. Через їх взаємний вплив можна було б очікувати більш-менш рівномірного розподілу молярної частки цих груп за рК, як це має місце для самої гумінової кислоти. Однак крива титрування нанокластерної системи (Рис.3) несподівано демонструє два чітких стрибки, які можуть відповідати протонуванню двох типів аніонних центрів, а саме, іонізованих гідрокси- та карбоксигруп. Сумарне рівняння реакції протонування запишеться у такому вигляді:
[Ag(2n+1)Hm(O)n] (z+n) – + (x + n)H+ ® H(z+n)[Ag(2n+1)Hm(O)n]¯.
Кислота H(z+n)[Ag(2n+1)Hm(O)n]¯ випадає у вигляді коричневого осаду, який після промивання декантацією і наступного центрифугування може бути повністю розчинений при додаванні розчину лугу. Одержаному у такий спосіб продукту ми даємо назву Гумаргол. Осад кислоти залишається розчинним у лузі і після його висушування при 100 ºC.
Осадження наноклатерної системи іонами Cu2+ може проходити з утворенням солі описаної вище кислоти згідно з рівнянням:
[Ag(2n+1)Hm(O)n](z+n) – + (x + n)/2Cu2+ ® Cu(z+n)/2[Ag(2n+1)Hm(O)n]¯.
Результатом взаємодії є утворення коричневого осаду, нерозчинного у
воді та у розчинах лугу, але розчинного у 5% розчині амоніаку. Висушений осад
мідної солі має металічний блиск і не втрачає здатності розчинятись в амоніаку.
Аналогічні властивості демонструють і солі інших полівалентних металів.
Натомість, солі
лужних металів розчинні у воді, і в тверду фазу їх можна перевести заміною розчинника. Так, додавання
подвійного об’єму ацетону до синтезованої ex tempore
нанокластерної системи, дає чорний, після висушування зелений з металічним
блиском, осад натрієвої солі. Цей 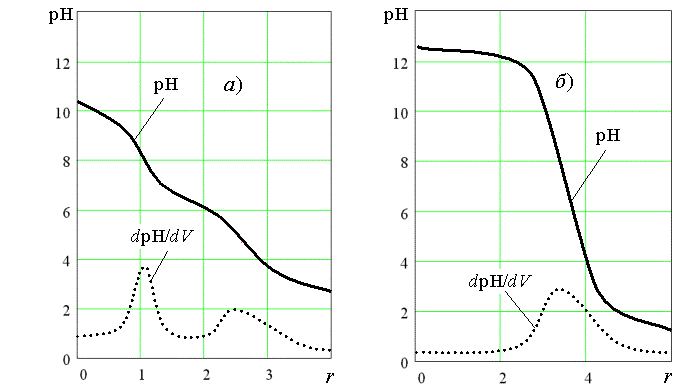
осад дуже гігроскопічний, легко розчиняється у воді.
Рис.3. Криві титрування срібної нанокластерної системи
(a) та вихідної синтетичної гумінової кислоти (б)
0,1 М розчином HNO3 (r = n(H+)/n(Hm))
Взаємодію
нанокластерної системи з мідною сіллю вивчали шляхом введення надлишкової
кількості купрум(ІІ) нітрату. Розчин з осадом центрифугували при 2500 об/хв і у
центрифугаті визначали вміст Cu2+-йонів стандартним іодометричним методом. Знайдене
у такий спосіб молярне відношення n(Cu2+)/n(Hm)) виявилось рівним 1,76.
Одержані результати показують, що
гуматстабілізовані наночастинки металічного срібла можна розглядати як
багатозарядні макроаніони які можуть стехіометрично взаємодіяти з
гідроген- та метал-іонами з утворенням кислотоподібних та солеподібних
продуктів. Сáме стехіометричність взаємодії дозволяє розглядати такі
об’єкти як молекулярні нанокластери і відкриває широкі перспективи для їх
використання у різноманітних галузях науки, техніки і технології.
Література
1. Федоренко К. В., Литвин
В. А., Галаган Р. Л. Про деякі загальні підходи до синтезу аналогів природних
гумінових кислот. У збірн. Материали за V
международна практична конференция
«Найновите научни постижения – 2009», Т.21, София, 17-25 март 2009. - С. 8-12.
2. Литвин В. А., Галаган Р. Л. Потенціометричне
дослідження кінетики і механізму утворення наночастинок срібла в реакції
відновлення Ag+-йонів синтетичними фульватами // Наукові
записки Тернопільського нац. пед. унів., серія Хімія, вип. 13, 2008.
– С. 47-50.
3. Серрей А. Справочник по органическим реакциям. Перев. с англ. под ред. докт. хим.
наук. Н.С. Вульфсона. –М.: Госхимиздат, 1962. – С.279-281, 300с.