Биологические науки/11биоинженерия и биоинформатика
Балакина А.А.1,
д.б.н. Калашникова Е.А.2
1Институт
проблем химической физики РАН, Российская Федерация
2
Российский государственный аграрный университет – МСХА
имени К.А. Тимирязева, Российская Федерация
Влияние типа
первичного экспланта на морфогенез люпина узколистного (Lupinus angustifolius L.) в культуре
in vitro
Некоторые виды рода Lupinus широко
используются в мировом сельском хозяйстве в качестве источника белка для пищи
человека и животных. В последние годы в ряде стран ведется активная работа по
усовершенствованию методик клонального микроразмножения и трансформации люпина
узколистного [3]. Следует отметить, что, как и все зернобобовые, люпин является
сложной культурой как для получения стабильной регенерации, так и для
проведения генетических манипуляций. Одной из проблем является отмеченная
многими авторами высокая специфичность отдельных сортов к условиям
культивирования in vitro, что в
свою очередь обуславливает низкую воспроизводимость разрабатываемых протоколов [4].
В работе использовали следующие сорта и образцы люпина узколистного:
Ладный
(РГАУ-МСХА имени К.А. Тимирязева, НПО «Подмосковье»); Деко (образец НПО
«Подмосковье»); Куршавель (БелНИИЗБК); Миртан (БелНИИЗБК). Материал
предоставлен кафедрой селекции и семеноводства полевых культур РГАУ-МСХА имени
К.А. Тимирязева.
Все питательные
среды были приготовлены на основе сред Мурасиге-Скуга [2] и Гамборга [1] с
добавлением 0,8 % агара (Bacto-Agar). В качестве регуляторов
использовали 6-бензиламинопурин (6-БАП), кинетин (КИН) в различных
концентрациях. Питательные среды доводили до рН 5,7 и автоклавировали в течение
20 минут при температуре 1200С. Первичные экспланты и микропобеги
культивировали при интенсивности света 5000 люкс, 16-часовом фотопериоде и
температуре 24±10С.
Семена люпина промывали проточной водой и протравливали препаратом
Максим (действующее
вещество тебуконазол) с рекомендуемой производителем концентрацией и
экспозицией в течение 10 суток. Затем семена стерилизовали 50%-м раствором
коммерческого отбеливателя «Белизна» с добавлением 0,01 % Tween
20 в течение 15 минут с последующей 3-4-х кратной отмывкой их стерильной
дистиллированной водой. Стерильные семена помещали на агаризованную питательную
среду, содержащую половинную концентрацию микро- и макросолей по прописи
Мурасиге-Скуга, половинную концентрацию витаминов по прописи Гамборга, 29,2 мМ
сахарозы, 0,8% агара (Bacto-Agar) и проращивали в
термостате при температуре 20ºС. Полученные проростки разделяли на
первичные экспланты: 1) пазушные почки с семядолей и фрагментом зародышевой
оси; 2) верхушечные почки.
Опыты проводили в четырехкратной
повторности. Данные экспериментов представлены в виде ![]() , где
, где ![]() - среднее значение,
- среднее значение, ![]() - ошибка средней, t05 –
значение критерия Стьюдента.
- ошибка средней, t05 –
значение критерия Стьюдента.
На этапе
введения в культуру наши исследования были направлены на выявление оптимальных
условий для эффективной первичной регенерации и развития регенерантов. Для
этого индуцировали образование побегов из пазушных и верхушечных почек на
экспланте, а также из меристем с двумя примордиями. Установлено, что все
исследуемые генотипы легко образовывали побеги как в присутствии, так и в
отсутствии цитокининов.
Изолирование
меристем является трудоемким процессом, однако позволяет избежать заражения
грибными, бактериальными и вирусными инфекциями. В наших экспериментах
эффективность регенерации при использовании данного типа экспланта была низкой
и составила от 26,7 до 46,7% для апекальных меристем и 38,3-56,7% для пазушных
меристем в зависимости от генотипа. В связи с тем, что формирование побегов происходило
в течении 25-30 суток, применение данного приема не является эффективным для
клонального микроразмножения и агробактериальной трансформации люпина
узколистного.
Использование в
качестве первичного экспланта верхушечных почек позволяло получить только один
побег, в то время как из пазушных почек развивались 2-4 побега с эффективностью
регенерации до 93,3 %. Семядоли являются дополнительным источником питательных
веществ для регенерантов и, по-видимому, их наличие стимулирует более быстрое развитие
побегов, как из почек, так и из меристем (14 и 20 суток соответственно). Нами
не было отмечено существенных различий по эффективности регенерации между
исследуемыми генотипами при использовании данных типов первичных эксплантов,
что обуславливает возможность их применения для получения стабильной
регенерации побегов из почек.
Другим подходом
к увеличению регенерационного потенциала зернобобовых культур in vitro
является культивирование сегментов незрелых зародышей [5]. В наших экспериментах
в качестве первичных эксплантов были использованы семядоли с пазушной почкой,
изолированные с 3-х суточных проростков и незрелых зародышей на стадии восковой
спелости. В питательную среду добавляли различные концентрации кинетина и
6-БАП. Наилучшие результаты были получены в вариантах с присутствием кинетина в
концентрациии 1,13 мкМ и 6-БАП в концентрации 2,25 мкМ. Существенных различий
по регенерационной способности между сортами и типами первичных эксплантов не
наблюдали (рис. 1).
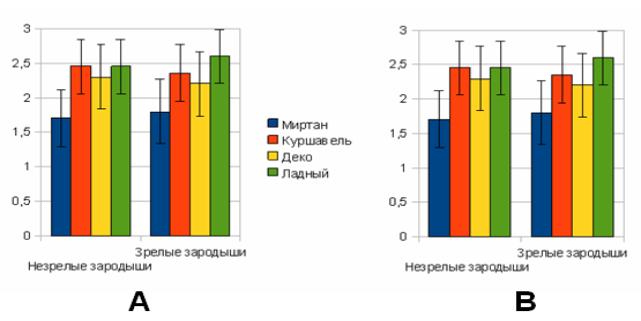
Рис. 1. Среднее
количество побегов с одного экспланта, шт.
А — в присутствии 1,13 мкМ кинетина, В — в
присутствии 2,25 мкМ 6-БАП
Проведенные
эксперименты показали, что наиболее предпочтительным источником первичных
эксплантов являются зрелые зародыши люпина узколистного, поскольку в отличие от
незрелых зародышей их легче получать, хранить и можно использовать круглый год
без выращивания донорных растений в теплице. Таким образом, пазушные почки с
семядолей и фрагментом зародышевой оси являются наиболее подходящими для
клонального микроразмножения и для дальнейшего проведения агробактериальной
трансформации люпина узколистного.
Как и другие бобовые
культуры, люпин узколистный требователен к составу питательных сред. Для
культивирования микрорастений люпина in vitro обычно используют
модифицированные питательные среды МС и В5 с добавлением различных концентраций
цитокининов. Однако высокие дозы 6-БАП оказывают негативное действие на
развивающиеся побеги, выражающееся в витрификации побегов, замедлении роста и
нарушениях в морфологии [4]. В наших экспериментах использовали концентрации
КИН и 6-БАП от 0,45 до 6,75 мкМ, а также питательные среды без добавления
регуляторов роста. Влияние различного гормонального состава оценивали по двум
показателям: среднее количество побегов, образующихся на одном первичном
экспланте (шт.) и скорость регенерации (сутки). Наилучший результат был получен
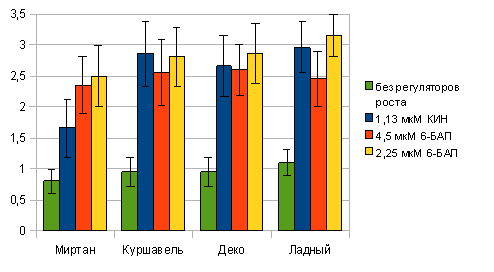
в вариантах с добавлением 1,13 мкМ КИН, 2,25 или 4,50 мкМ 6-БАП (Рис. 2).
Рис. 2.
Эффективность регенерации люпина узколистного
Следует
отметить, что использование концентраций 6-БАП больше 2,25 мкМ вызывало
витрификацию побегов, а выше 4,5 мкМ — образование каллусной ткани на первичном
экспланте. Наиболее быстрое развитие побегов из пазушных почек наблюдали в
вариантах без добавления регуляторов роста (10-12 суток). При увеличении
концентрации КИН и 6-БАП до 2,25 мкМ время развития побегов увеличивалось до
14-15 суток, а при использовании более высоких концентраций до 20-22 суток.
Таким образом, для получения первичной
регенерации из пазушных почек люпина узколистного наиболее оптимальной является
питательная среда на основе макро- и микросолей МС с добавлением витаминов по
прописи Гамборга и 2,25 мкМ 6-БАП или 1,13 мкМ КИН в качестве регуляторов
роста.
Литература:
1.
Gamborg O, Miller R, Ojima K 1968 Nutrient requirements of suspension
cultures of soybean root cells Exp Cell Res 50:151-158
2.
Murashige T, Skoog F 1962 A revised medium for rapid growth and
bioassays with tobacco tissue cultures Physiol Plant 15:473-497
3.
Pigeaire A, Abernethy D, Smith PM, Simpson K, Fletcher N, Lu C, Atkins
CA, Cornish E 1997 Transformation of grain legume (Lupinus angustifolius
L.) via Agrobacterium tumefaciens-mediated gene transfer to shoot apices
Molecular Breeding 3:341-349
4.
Pniewski T, Kapusta J, Legocki AB 2002 In vitro micropropagation
of four lupin species Acta Phisiol Plant 24:417-424
5.
Popelka JC, Gollasch S, Moore A, Molving L, Higgins TJV 2006 Genetic
transformation of cowpea (Vigna unguiculata L.) and stable transmission
of the transgenes to progeny Plant Cell Rep 25:304-312