Химия и химические
науки/5. Фундаментальные
проблемы создания новых
материалов и технологий
Д.х.н. Алыков Н.М., к.х.н. Алыкова Т.В.,
магистрант Каирбаева Т.И.
Астраханский
государственный университет, Россия
Сорбционное
концентрирование желчных кислот
Основной составной
частью желчи, образующейся в печени животных и человека, являются желчные
кислоты, среди них наиболее известны холевая, дезоксихолевая и гликохолевая
кислоты.
Желчные кислоты являются
важным средством получения стероидных физиологически – активных веществ.
Концентрирование желчных кислот с использованием различных сорбентов дает
возможность получить концентраты этих желчных кислот, которые после десорбции и
препаративной хроматографии могут быть получены в чистом виде. Данные по
сорбционному концентрированию желчных кислот на углях со специальными заданными
свойствами в литературе не найдены.
Целью данной работы явилось изучение сорбции желчных кислот на углях,
полученных путем карбонизации скорлупы абрикосовых косточек в виде пыли с диаметром частиц 0,001 мм (АУ –
0,001) и частиц с диаметром 0,5 мм (АУ – 0,5), а также на активном угле БАУ –
А.
Для получения гомогената желчных кислот использовали желчь сазана
(волжского). Для этого приготавливали водный раствор, в 100 г которого содержалось
6 г желчи. С
целью отделения от взвешенных частиц полученный раствор через 1 час фильтровали
через бумажный фильтр «белая лента».
Изотермы
сорбции
желчных кислот из водных растворов угольными сорбентами изучены в статическом
режиме при температурах 278±0,5 К,
298±0,5 К и 323±0,5 К.
Для каждой температуры приготавливали по
четыре одинаковых серии растворов желчи:
Серия 1. В 14 пробирок отбирали по 0,5;
1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0; 5,0; 6,0; 7,0; 8,0; 9,0; 10,0 см3
6 % раствора желчи, далее доводили объем до 10 см3 дистиллированной
водой. После тщательного перемешивания полученные растворы отфильтровывали
через бумажный фильтр «белая лента», фильтраты переносили в конические колбы
емкостью 100 см3, вносили по 3 капли фенолфталеина (1 %) и титровали
0,001 М раствором NaOH.
Серия 2, 3, 4. В 14
пробирок отбирали по 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0; 5,0; 6,0; 7,0;
8,0; 9,0; 10,0 см3 6 % раствора желчи, далее доводили объем до 10 см3 дистиллированной водой
и термостатировали, добавляли в каждую пробирку по 0,5 г одного из угольных
сорбентов, тщательно перемешивали в течение 10 минут, отфильтровывали
полученные растворы, после чего содержимое пробирок переливали в конические
колбы емкостью 100 см3, вносили по 3 капли 1 % фенолфталеина и
титровали 0,001 М раствором NaOH. По результатам
титрования рассчитали концентрации желчных кислот в приготовленных растворах до
и после сорбции различными сорбентами при трех температурах (табл.1).
Таблица 1
Концентрация желчных кислот в растворах желчи
до и после сорбции сорбентами АУ – 0,001, АУ – 0,5, БАУ – А
|
№ п.п. |
Vжелчи, см3 |
Концентрация
желчных кислот, Сж.к.·104 моль/дм3 |
|||||||||||
|
до сорбции |
После
сорбции |
||||||||||||
|
АУ – 0,001 |
АУ – 0,5 |
БАУ – А. |
|||||||||||
|
278 К |
298 К |
323 К |
278 К |
298 К |
323 К |
278 К |
298 К |
323 К |
|||||
|
1 |
0,5 |
2,9 |
2,0 |
1,3 |
0,8 |
2,4 |
2,2 |
1,7 |
1,5 |
1,0 |
0,7 |
||
|
2 |
1,0 |
6,1 |
4,4 |
3,1 |
1,8 |
5,3 |
4,9 |
4,0 |
3,3 |
2,2 |
1,5 |
||
|
3 |
1,5 |
9,0 |
6,7 |
4,8 |
2,8 |
8,1 |
7,5 |
6,3 |
5,2 |
3,4 |
2,3 |
||
|
4 |
2,0 |
12,2 |
9,2 |
6,8 |
4,0 |
11,2 |
10,5 |
8,9 |
7,3 |
4,8 |
3,3 |
||
|
5 |
2,5 |
15,2 |
11,7 |
8,8 |
5,4 |
14,2 |
13,2 |
11,6 |
9,5 |
6,3 |
4,3 |
||
|
6 |
3,0 |
18,5 |
14,5 |
11,3 |
7,1 |
17,5 |
16,4 |
14,5 |
12,0 |
8,0 |
5,5 |
||
|
7 |
3,5 |
21,6 |
17,2 |
13,5 |
8,8 |
20,5 |
19,4 |
17,4 |
14,5 |
9,8 |
6,9 |
||
|
8 |
4,0 |
24,6 |
19,8 |
16,0 |
10,7 |
23,5 |
22,3 |
20,2 |
16,9 |
11,5 |
7,9 |
||
|
9 |
5,0 |
31,1 |
25,7 |
21,5 |
15,9 |
30,0 |
28,6 |
26,4 |
22,5 |
15,5 |
11,1 |
||
|
10 |
6,0 |
37,0 |
31,0 |
26,6 |
20,9 |
35,9 |
34,4 |
32,1 |
27,8 |
19,8 |
14,7 |
||
|
11 |
7,0 |
43,2 |
36,8 |
32,3 |
26,5 |
42,1 |
40,5 |
38,1 |
33,4 |
24,7 |
18,7 |
||
|
12 |
8,0 |
49,3 |
42,5 |
38,2 |
32,1 |
48,1 |
46,6 |
44,1 |
39,1 |
29,8 |
22,7 |
||
|
13 |
9,0 |
55,5 |
48,3 |
44,1 |
37,6 |
54,3 |
52,7 |
50,2 |
45,0 |
35,5 |
27,3 |
||
|
14 |
10 |
61,4 |
53,9 |
49,8 |
42,9 |
60,2 |
58,6 |
56,0 |
50,5 |
40,6 |
32,3 |
||
Величину сорбцию Г
(моль/г) рассчитывали по формуле:
|
|
где С0 –
концентрация желчных кислот до сорбции, моль/дм3;
[С] – равновесная
концентрация желчных кислот после сорбции, моль/дм3;
V –
объем раствора желчи, из которого проводили сорбцию, дм3;
m –
масса сорбента, г.
Общая характеристика
сорбционных процессов оценена на основании изучения изотерм в координатах
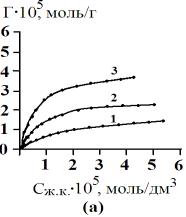
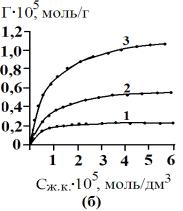
«величина сорбции – равновесная концентрация» (рис.1).
Было проведено по шесть
параллельных определений для каждой температуры.
|
|
|
|
|
Рис. 1 Изотермы сорбции желчных кислот сорбентом АУ
– 0,001 (а), АУ – 0,5 (б), БАУ – А (в). 1 – 278 К, 2 – 298
К, 3 – 323 К |
||
Как видно из рис.1 изотермы
сорбции желчных кислот на сорбентах АУ
– 0,001, АУ – 0,5, БАУ – А можно отнести к изотермам по Ленгмюру.
В литературе подобные
закономерности объясняются усилением притяжения между молекулами сорбата и их
переориентацией, а также возникновением конкуренции молекул растворителя за
активные центры сорбата.
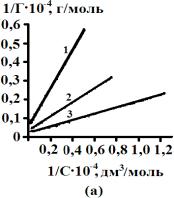
Расчеты предельной
сорбции (Г∞) и констант сорбции К278, К298,
К323 проводили с использованием уравнения Ленгмюра в прямолинейной
форме. Для этого строили график в координатах «обратная величина сорбции –
обратная величина равновесной концентрации».
|
|
|
|
|
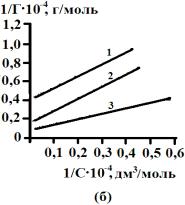
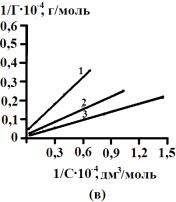
Рис.2.
Зависимость обратной величины сорбции желчных кислот на активных углях от
обратной величины равновесной концентрации. АУ – 0,001 (а), АУ – 0,5 (б), БАУ – А (в). 1 – 278 К, 2 – 298 К, 3 – 323 К |
||
Отрезок, отсекаемый от
оси ординат равен ![]() ,
а тангенс угла наклонной прямой:
,
а тангенс угла наклонной прямой: 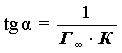 .
Различие в адсорбции при разных
температурах позволило рассчитать термодинамические характеристики сорбции:
изменение энтальпии (ΔH),
изобарно-изотермического потенциала (ΔG) и энтропии (ΔS).
.
Различие в адсорбции при разных
температурах позволило рассчитать термодинамические характеристики сорбции:
изменение энтальпии (ΔH),
изобарно-изотермического потенциала (ΔG) и энтропии (ΔS).
Результаты расчетов
приведены в табл.2.
Таблица 2
Основные характеристики сорбции желчных кислот угольными
сорбентами (p=0,9; tp=2,02; n=6)
|
Сорбент |
Т, К |
К·10–3 |
– Δ H, кДж/моль |
– ΔG,
кДж/моль |
ΔS, Дж·моль/К |
Г∞,
мг/г |
|
АУ – 0,001 |
278 |
0,56±0,05 |
10,11±0,9 |
14,63±1,25 |
16,24±1,50 |
6,80 |
|
298 |
1,08±0,10 |
17,30±1,62 |
24,15±2,25 |
9,60 |
||
|
323 |
1,03±0,09 |
18,63±1,75 |
26,37±2,31 |
20,57 |
||
|
АУ – 0,5 |
278 |
2,81±0,21 |
12,55±1,15 |
18,36±1,72 |
20,88±1,95 |
0,91 |
|
298 |
1,35±0,12 |
17,85±1,68 |
17,79±1,65 |
2,27 |
||
|
323 |
1,32±0,12 |
19,29±1,83 |
20,87±1,95 |
5,35 |
||
|
БАУ – А |
278 |
0,83±0,08 |
3,50±0,20 |
15,54±1,40 |
43,30±3,80 |
9,35 |
|
298 |
0,82±0,07 |
16,61±1,55 |
43,90±3,84 |
18,70 |
||
|
323 |
0,73±0,06 |
17,71±1,65 |
43,99±3,85 |
31,04 |
Результаты, приведенные
в табл. 2, свидетельствуют о том, что с повышением температуры сорбция желчных
кислот на угольных сорбентах возрастает.
Сорбционные характеристики сорбента АУ – 0,001 соизмеримы с сорбционными характеристиками сорбента БАУ – А, с
увеличением размеров частиц сорбента его сорбционная емкость уменьшается.
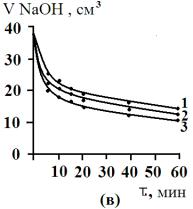
Кинетика сорбции. В широкогорлую колбу емкостью 500 см3
при определенной температуре (278, 298 и 323 К) приливали 200 см3 6
%-ного раствора желчи. Вносили 10 г одного из сорбентов (АУ – 0,001, АУ – 0,5 или БАУ – А), быстро
перемешивали и одновременно включали секундомер. Через определенные промежутки
времени (1, 5, 10, 15, 20, 40, 60 мин) отбирали пробы мутных растворов и
отфильтровывали их. Далее из каждой пробы отбирали по 10 см3 раствора, добавляли по
3 капли фенолфталеина и титровали 0,001 М раствором NaOH.
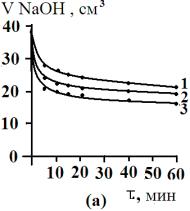
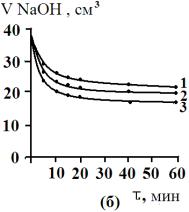
По
результатам титрования строили изотермы кинетики сорбции в координатах «объем
0,001 М раствора NaOH –
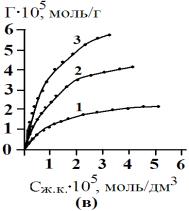
время». Изотермы кинетики сорбции желчных кислот различными сорбентами
приведены на рис.3.
|
|
|
|
|
Рис.3. Изотермы кинетики сорбции желчных кислот угольными
сорбентами АУ
– 0,001 (а), АУ – 0,5 (б), БАУ – А (в). 1 – 278 К, 2 – 298 К, 3 – 323
К. |
||
Как видно
из рис. 3, для сорбционных процессов при различных температурах характерен
достаточно крутой начальный участок изотерм кинетики сорбции. Сорбция желчных
кислот на изучаемых сорбентах протекает достаточно быстро и практически
заканчивается через несколько минут.
Так как
сорбция представляет собой односторонний процесс, подчиняющий кинетическому
уравнению первого порядка, то для расчета константы скорости сорбции
использовали следующее уравнение:
|
|
где V0 – объем раствора NaOH, пошедший на титрование раствора до сорбции, см3; Vi – объем раствора NaOH, пошедший на титрование раствора после сорбции
в момент времени ti.
Рассчитанные
по данным кинетики сорбции константы скоростей сорбции К278, К298, К323
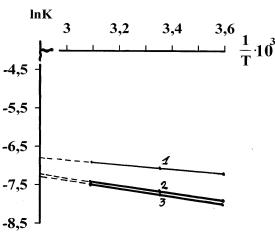
использовали для графического решения уравнение Аррениуса.
Были
построены графики в координатах « ln К – 1/Т »
(рис.4).
|
|
|
Рис. 4. Зависимость ln К сорбции желчных кислот на различных сорбентах от обратной
величины температуры. 1 – БАУ – А, 2 – АУ – 0,001, 3 – АУ – 0,5 |
Прямая
отсекает от вертикальной оси отрезок, численно равный логарифму
предэкспоненциального фактора (lnPZ0).Тангенс угла
наклона этой прямой: tgφ = – Eакт/R.
С
использованием уравнения Эйринга были рассчитаны изменения энтропии образования
активированного сорбционного комплекса (ΔS#):
|
|
Результаты
расчетов Еакт, ΔS# и PZ0 при образовании
активированного сорбционного комплекса в системе «сорбент – желчные кислоты» приведены
в табл. 3.
Таблица
3
Термодинамические
характеристики кинетики сорбции желчных кислот
на сорбентах
|
Сорбент |
Т,
К |
К∙104, с–1 |
–
lnPZ0 |
–
ΔS#, Дж/(моль∙К) |
Еакт,
кДж/моль |
|
АУ – 0,001 |
278 |
3,64±0,34 |
7,30±0,60 |
193,61±16,1 |
9,86±0,90 |
|
298 |
4,97±0,45 |
194,19±16,0 |
|||
|
323 |
5,96±0,50 |
194,86±16,1 |
|||
|
АУ – 0,5 |
278 |
3,58±0,32 |
7,40±0,65 |
194,45±16,2 |
12,60±0,95 |
|
298 |
4,37±0,37 |
195,02±16,3 |
|||
|
323 |
5,69±0,46 |
195,69±16,3 |
|||
|
БАУ – А |
278 |
7,42±0,70 |
6,85±0,55 |
189,87±15,0 |
4,10±0,23 |
|
298 |
8,55±0,81 |
190,45±15,2 |
|||
|
323 |
9,95±0,90 |
191,12±15,3 |
Анализ
результатов, полученных при исследовании статики и кинетики сорбции, позволяет
считать, что сорбция желчных кислот на угольных сорбентах протекает в две
стадии. Начальная стадия взаимодействия в системе «желчные кислоты – угольный
сорбент» – это процесс, связанный с формированием активированного сорбционного
комплекса, сопровождающийся отрицательным изменением ΔS# (табл. 3). Это
означает, что начальная стадия сорбции – это односторонний процесс закрепления
желчных кислот на угольном сорбенте. Далее активированный комплекс переходит в
более устойчивое состояние, когда происходит перераспределение связей, при этом
величина ΔS увеличивается (табл. 2).
Приведенные результаты
показали, что эти сорбенты являются перспективными материалами для накопления
кислот с целью дальнейшего их использования для получения стероидных
физиологически-активных веществ.
Литература
1. Овчинников, Ю. А. Биоорганическая химия
[Текст] / Ю. А. Овчинников. – М.: Просвещение. - 1987.
– 815 с.: ил.
2. Машковский,
М. Д. Лекарственные средства [Текст] /
М. Д. Машковский. - М.: ООО «Изд-во Новая Волна». - 2004. - 608 с.
3. Грег,
С. Адсорбция, удельная поверхность, пористость [Текст] / С. Грег, К. Синг. –
М.: «МИР». - 1970. - 407 с.