Хімія і хімічні технології/6. органічна хімія
К.х.н. Калин Т.І.1,
к.х.н. Мельник М.В.2, к.х.н. Боднарчук О.В. 2
1Івано-Франківський національний технічний університет нафти і газу,
2Івано-Франківський національний медичний університет, Україна
Взаємодія 1,8-діоксодекагідроакридинів з похідними аміаку
Похідні полігідроакридинів
володіють протимікробною [1,2], фунгіцидною [3], нейропротекторною [4] та
іншими видами фізіологічної активності [5]. При взаємодії продукту конденсації
ацетальдегіду і димедону – біс-цикло-гександієнілетану із заміщеними анілінами утворюються
1,8-діоксо-декагідроакридини [6] ,що також проявляють протимікробну активність
[7].
Наявність в структурі
1,8-діоксодекагідроакридинів кетонних груп робить можливим проведення реакцій з
нуклеофільними реагентами, такими як гідроксиламін, гідразин, фенілгідразин та
іншими похідними аміаку. Введення в структуру цих сполук фрагментів
фармакофорів розширює спектр речовин, що володіють біологічною активністю. Тому
розробка методів синтезу нових похідних декагідроакридину із функціональними
замісниками у положеннях 1,8 акридинового кільця є актуальною проблемою.
Класичний метод одержання оксимів
базується на взаємодії альдегіду чи кетону з солянокислим гідроксиламіном в
присутності водного лугу, спиртового лугу, ацетату натрію в діоксані, у водному
розчині соди [8].
Нами
проведено синтез оксимів
N-арил-3,3,6,6,9-пентаметил-1,8-діоксодекагідроакридинів (1а-г) при кип’ятінні як в піридині, так і в ізопропіловому спирті,
при цьому вищий вихід спостерігався при використанні піридину. За допомогою
мас-спектрометричних досліджень встановлено, що в умовах реакції утворюються дизаміщені похідні
N-арил-3,3,6,6,9-пентаметил-1,8-діоксодекагідроакридинів (2а-г) :
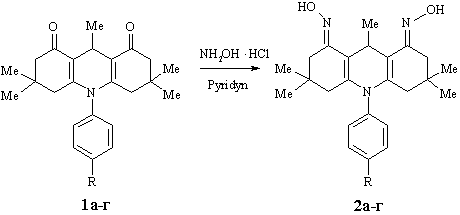
R=H (1, 2а), 4-C4H9COO (1, 2б) , 4-NO2 (1, 2 в), 4-Cl (1, 2г)
Відомі методи
одержання фенілгідразонів у воді в присутності ацетату натрію або у безводному
піридині [9], в крижаній ацетатній кислоті [10]. Виявлено [11], що при
нагріванні декагідроакридин-1,8-діонів, незаміщених в положенні 9, з трикратним
надлишком фенілгідразину в ізопропіловому спирті з сульфатною кислотою
утворюються бісфенілгідразони, які перетворюються в продукт перегрупування
Фішера при більшому співвідношенні сульфатної кислоти до спирту.
Нами
проведено синтез фенілгідразонів похідних 1,8-діоксодекагідроакридинів в крижаній
ацетатній кислоті. Внаслідок наявності метильної групи в положенні 9 та системи
супряження між карбонільними групами у молекулах 1,8-діоксодекагідроакридинів реакційна
здатність декагідроакридиндіонів-1,8 зменшується. Нами встановлено, що в умовах
синтезу замість очікуваних бісфенілгідразонів утворюються монопохідні
фенілгідразони N-арил-3,3,6,6,9-пентаметил-1,8-діоксодекагідроакридинів 3а-г:
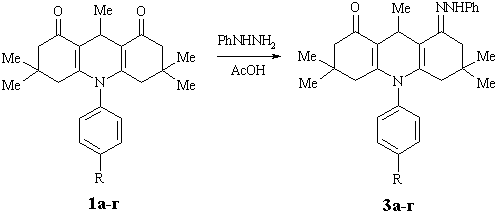
R=H (3а), 4-C4H9COO (3б) , 4-NO2 (3в), 4-Cl (3г)
Найімовірніше,
наявність метильного замісника в 9-му положенні декагідроакридинового
фрагменту, що створює певні стеричні утруднення, спричинює утворення моно-, а
не бісфенілгідразонів N-арил-3,3,6,6,9-пентаметил-1,8-діоксодекагідроакридинів.
Натомість, проведення синтезу з декагідроакридиндіоном 1е в аналогічних умовах призвело до одержання бісфенілгідразону
N-феніл-3,3,6,6-тетраметил-1,8-діоксодекагідрокридину 3е.
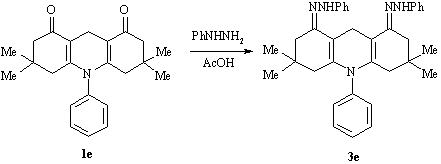
Перспективним
є синтез тіосемікарбазонів похідних 1,8-діоксодекагідроакридинів у зв’язку з наявністю противірусних (кутизон, метисазон),
протитуберкульозних препаратів (солютизон, тіоацетазон) [12], які містять фрагмент молекули тіосемікарбазиду.
Нами
встановлено, що при взаємодії сполук 1а-г з трикратним надлишком
тіосемікарбазиду в етанолі утворюються монотіосемікарбазони
N-арил-1,8-діоксодекагідроакридинів 4а-г:
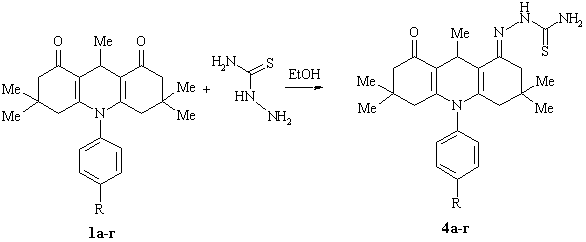
R=H (4 а), 4-C4H9COO (4 б) , 4-NO2 (4 в), 4-Cl (4 г)
Будова
одержаних речовин підтверджена ЯМР 1Н спектрами, склад –
результатами елементного аналізу та мас-спектрометрії.
ЛІТЕРАТУРА
1. Щекотихин Ю.М., Николаева Т.Г., Шуб Г.М., Кривенько А.П. / Хим.-фармац. журн. 2001. 4. С.206 – 208.
2. Al-Ashmawi, Mohamed I.;
El-Sadek [et al.] / Journal of
Pharmaceutig Sciences. 1994. 3. P.144–150.
3. Андреева Е.И., Смирнова Г.К.,
Рожкова Н.Г. и др. / Физиол. акт. вещества.
1985. 17. С.
84–87.
4. Burov, Yu. V.; Uzdenskii, A. B.; Robakidze, T. N. / Bulletin of
Experimental Biology and Medicine. 2000. 4. Р.362–364.
5. Андреева Е.И., Смирнова Г.К., Рожкова Н.Л. и др. / Физиол. активные вeщества. 1990. 22. C.57–60.
6. Мельник М.В., Туров А.В.,
Калин Т.І. / Доповіді НАНУ. 2003. 5. С.142–145.
7.Мельник М.В., Калин Т.І., Куцик
Р.В./Фарм. журн. 2004. 4. С.78–83.
8. Э.Абеле, Р. Абеле, О. Дзенитис, Э. Лукевиц. / ХГС. 2003. 1. С.5-37.
9. Физер Л. Современные методы в органической химии. М.: ГХИ, 1960. –
С.108-112.
10. Мельник М.В. / Укр. хим. журн. 2001.
Т.67. 6. С.103-107.
11. Т.Г. Николаева, Ю.М. Щекотихин,
Ю.А. Гетманенко [и др.] / ХГС .2000. 3. C. 416–417.
12. Зозуляк В.І. /
Фтизіатрія . Ів.-Фр.: ІФДМА, 2000. 82 с.