К.х.н Джигола Л.А., Куаталиева С.Б., Никитина О.В., Рогатина
Ю.М.
Астраханский государственный университет, Россия
Исследование кинетики сорбции ионов
Cu (II), Hg(II), Cd (II), Fe(III), Pb(II), Cs алюмосиликатами
Для аккумуляции ионов тяжёлых металлов из
объектов окружающей среды наиболее эффективно, экономически рентабельно и
экологически безопасно использование природных сорбентов и композитов на их
основе [1].
Нами проведено исследование изотерм и условия
сорбции алюмосиликатов по отношению к ионам тяжелых металлов: Cu (II),Hg(II),
Cd (II), Fe(III), Pb(II), Cs при температурах 275 и 298К. Установлено, что сорбция
данных ионов металлов эффективна (95-99% -степень поглощения) в широком
интервале концентраций от 10-1-10-7 моль/дм3,
оптимальное соотношение массы алюмосиликата к объёму пробы: 1-2 г/50 см3.
Изотермы сорбции ионов металлов могут быть отнесены к изотермам Ленгмюра,
используя уравнение Ленгмюра в линейной форме определены сорбционные
характеристики: константы сорбции; ёмкость алюмосиликатов, мг/г;
термодинамические характеристики: энтальпия, энтропия, изобарно-изотермический
потенциал. Сорбция носит экзотермический характер для ионов ртути и свинца, для
остальных ионов эндотермический [2-4].
Для установления времени сорбционного равновесия
и механизма сорбции необходимы кинетические исследования сорбции данных ионов. Кинетические
параметры в статических условиях определялись отдельно для каждого иона на
модельных растворах при нескольких температурах с использованием ионометрического
метода определения концентраций ионов, с
применением ионоселективных электродов: «ХС-Hg-001», «ХС-Pb-001»,
«ХС-Fe-001», «XC–Cd-001»,
«Элит-031», «Элит-227»,
относительно хлорсеребряного электрода сравнения «ЭВЛ-1М3.1» . Измеряли
потенциал электродов (Е, мВ) в растворах анализатором жидкости «ЭКСПЕРТ-001-3»
в режиме работы – вольтметр [5].
Из исходных растворов концентрацией 0,1
моль/дм3, содержащих ионы Cu (II), Hg(II), Cd (II), Fe(III), Pb(II), Cs методом
последовательного разбавления приготовили рабочие растворы солей металлов с
концентрацией 10-3 моль/дм3 объемом 50 см3,
добавили БРОИС (согласно
инструкциям к ИСЭ). Растворы термостатировали
при 295 К в течение одного часа. Далее измерили
потенциал ИСЭ (Е0) в растворах при τ=0
(до внесения алюмосиликата). Далее, в растворы внесли по 2 г алюмосиликата,
интенсивно перемешали, и начали фиксировать показания иономера через
определенные промежутки времени: 0, 5, 10, 20, 30, 40, 50, 60, 90, 120,
180 с, 5, 7, 10, 12, 15, 20, 25, 30 мин, 35 мин, 40
мин, 50 мин, 1 ч, 1,5 ч, 2 ч. Для учета фона параллельно провели такие же
измерения с холостым раствором. Проводили аналогичные исследования в температурном
интервале 273 - 333 К. Изотермы кинетики сорбции
ионов Cu (II), Hg(II), Cd (II), Fe(III), Pb(II), Cs
представлены на рис.1-6.
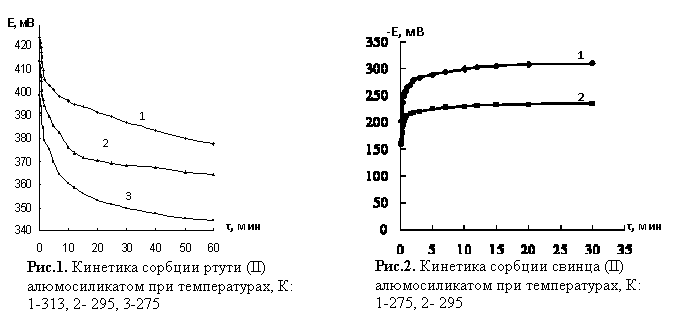
Анализ
изотерм сорбции ионов ртути и свинца (рис.1,2), позволяет отметить, что при уменьшении
температуры поглощение ионов значительно эффективнее. Равновесие в системе
(рис.1) при 275К достигается за 2 мин, при 295К за 7 мин, при 313К в течении двух
часов. При сорбции свинца (II) (рис.2) равновесие в
системе при 275 К достигается за 2-3 мин, а при 295 К за 30 сек.
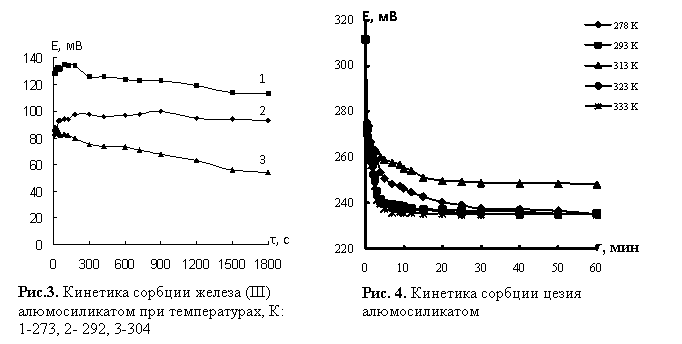
 При сорбции ионов железа
(III) (рис.3) равновесие при 273±0,5 К достигается за 10
мин, при 292±0,5
К за 3 мин, при 304±0,5 за 2 мин. Сорбция ионов цезия (рис.4)
протекает быстро: при 278±0,5 К за 15 мин, при 293±0,5 К за 7-10 мин, при
313±0,5
К в течении одного часа, при 323±0,5 К и 333±0,5 К за 5-7 мин. Эффективность
поглощения ионов железа (III) и цезия носит
возрастающий характер при увеличении температуры.
При сорбции ионов железа
(III) (рис.3) равновесие при 273±0,5 К достигается за 10
мин, при 292±0,5
К за 3 мин, при 304±0,5 за 2 мин. Сорбция ионов цезия (рис.4)
протекает быстро: при 278±0,5 К за 15 мин, при 293±0,5 К за 7-10 мин, при
313±0,5
К в течении одного часа, при 323±0,5 К и 333±0,5 К за 5-7 мин. Эффективность
поглощения ионов железа (III) и цезия носит
возрастающий характер при увеличении температуры.
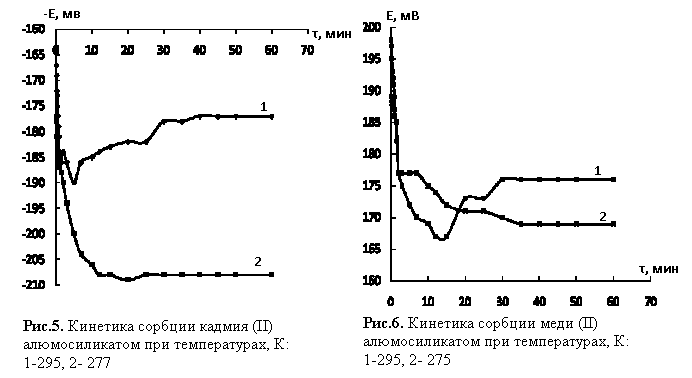
Из рис. 5 видно, что равновесие в системе «ионы кадмия
(II) – алюмосиликат» при 277±0,5 К достигается за 15
мин, при 295±0,5
К за 5 мин.
В
системе «ионы меди (II) – алюмосиликат» (рис.6) равновесие устанавливается
при 275±0,5
К за 30 мин, при 295±0,5 К за 10 мин. Эффективность поглощения ионов кадмия (II) и
меди (II) носит возрастающий характер при уменьшении температуры.
Для определения кинетического порядка и констант
скорости сорбции данных ионов построили линейные зависимости6 lnvi = f(ln[Ci]), где ki – константа скорости
сорбции иона алюмосиликатом в момент времени τ, численно равная отрезку
отсекаемому прямой по оси ординат; n – порядок реакции,
определяемый как угловой коэффициент прямой ( табл. 1).
Таблица 1
Кинетические параметры
сорбции ионов Cu (II), Hg(II), Cd(II), Fe(III), Pb(II), Cs алюмосиликатами, С0 = 10-3
моль/дм3
|
Графически
найденные результаты |
Ионы |
|||||
|
Cu2+ |
Hg2+ |
Cd2+ |
Fe3+ |
Pb2+ |
Cs+ |
|
|
Кинетический порядок реакции, n
при Т~295К |
1,19 |
0,97 |
1,2 |
1,31 |
0,9 |
1 |
|
Константы
скорости сорбции ионов алюмосиликатом, k |
||||||
|
Т~275К |
1,6·10-3 |
14,7·10-3 |
0.18∙10-5 |
4,310-3 |
4,8·10-2 |
0,31 |
|
Т~295К |
3,3·10-3 |
3,8·10-3 |
1,8∙10-5 |
7,3·10-3 |
1,77·10-2 |
0,38 |
Используя
уравнение Аррениуса в линейной форме и рассчитанные значения констант сорбции, графически
определили энергию активации и логарифм предэкспоненциального фактора. Используя уравнение Эйринга, рассчитали
изменение энтропии (DS#)
образования активированного адсорбционного комплекса. Результаты расчетов при
образовании активированных адсорбционных комплексов представлены в таблице 2.
Таблица 2
Характеристики процесса образования активированных
комплексов
|
|
Ионы |
|||||
|
Cu2+ |
Hg2+ |
Cd2+ |
Fe3+ |
Pb2+ |
Cs+ |
|
|
lnPZ0 |
18,1 |
7,85 |
3,1 |
0,28 |
0,18 |
0,67 |
|
Еакт,
кДж/моль |
24,2 |
13,7 |
8,7 |
11,64 |
33,65 |
16,62 |
|
-DS#295, Дж/моль×K |
95,49 |
156,41 |
219,4 |
301,8 |
217,4 |
127,8 |
|
-DS#275, Дж/моль×K |
95,41 |
154,8 |
-218,9 |
300,4 |
216,2 |
126,7 |
S
Результаты, приведенные в
табл.1 и 2 свидетельствуют о том, что процесс сорбции ионов Cu (II), Hg(II), Cd (II),
Fe(III), Pb(II), Cs протекает
через несколько стадий: начальная стадия взаимодействия в системах «ТМn+ - алюмосиликат» - это процесс формирования
активированного адсорбционного комплекса (АК*) и закрепления сорбата на
сорбенте. Это также хорошо иллюстрируется величинами DS# .
Энергия
активации этого процесса представляет собой энергию активации формирования
дублетов в данной системе, где основу взаимодействия составляют Ван-дер-Ваальсовы силы.
Полученные характеристики процесса образования
активированных комплексов позволили установить, что
при увеличении температуры скорость сорбции ионов Cu (II), Cd (II), Fe(III) и Cs увеличивается, а ионов Hg(II), Pb(II) уменьшается, что позволило сделать
вывод о механизме процесса сорбции: для ионов Cu (II), Cd (II), Fe(III) и Cs – начальная стадия ионный обмен, далее
преобладает хемосорбция; для ионов Hg(II), Pb(II) –
начальная стадия ионный обмен, далее преобладает физическая сорбция.
Литература:
1. Алыков, Н.М. Опоки
Астраханской области. Монография / Н.М Алыков, Т.В. Алыкова и др. – Астрахань.:
Изд. Дом «Астраханский Государственный Университет», 2005. – 140с.
2.
Джигола, Л.А. Очистка
воды и рассолов от калия, рубидия, цезия, кальция, стронция и бария / Т.В.
Алыкова, Н.М. Алыков, Л.А. Джигола и др. // Экология и промышленность России. -
2004. - №4. - С. 38-40.
3.
Симакова, Ю.М. Применение экспресс-метода ионометрии в изучении сорбции
ионов ртути (II) // Геология, география и глобальная энергия. - 2008. -
№3(30). - С.134-137.
4.
Джигола, Л.А. Использование ионометрии в изучении сорбции и
диффузии ионов тяжёлых металлов
/ Л.А. Джигола, А.В. Рублева,
Ю.М. Симакова, О.В. Никитина // В
мире научных открытий.- Красноярск. – 2010. - №4 (10). - Часть 15. - С. 118-121.
5.
Шевчук И.А., Симонова
Т.Н. Ионселективные электроды в анализе природных и промышленных объектов. –
Донецк «Норд-компьютеры», 2007. – 206 с.