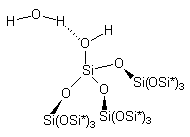Математика/5. Математическое моделирование
Д.х.н. Алыков Н.М.*, ст. преподаватель
Кожевникова Ю.Г.**
*Астраханский государственный университет,
Россия
*Астраханский инженерно-строительный
институт, Россия
Математическое
моделирование энергетических характеристик формирования соединений ионов металлов
с геологическими породами
и
материалами строительных конструкций
Целью работы явилось
теоретическое и экспериментальное изучение диффузии ионов лития, натрия, калия,
рубидия, цезия, бериллия, магния, кальция, стронция и бария в геологические
породы (глины, силикаты и алюмосиликаты) и в строительные материалы (цемент,
кирпич керамический и кирпич силикатный).
Эксперимент
проводился по общей методике, описанной в [1].
Вкратце его
можно представить так: образцы различных материалов с размерами 200 х 50 х 2 мм
вырезали или подготавливали прессованием в форме. Образцы помещали в пенал с
внутренними размерами 200 х 50 х 2 мм под углом 450, смачивали
водой, подсушивали в токе воздуха (вентилятор), на среднюю часть образца по
всей ширине наносили полоску пробы (раствор соли с концентрацией 0,01 моль/дм3.
Так как образец материала был увлажнен, нанесенная проба не растекалась.
Накрывали бокс стеклянной крышкой и герметизировали с помощью пластилина.
Продолжительность
опытов составила 365 дней. За это время соли щелочных и щелочноземельных
элементов диффундировали на расстояние Х. Это расстояние Х
находили по измерению содержания солей по всему образцу.
Диффузию изучали
при температурах (278±5)К, (298±5)К, и (318±5)К. После измерения расстояния Х
для каждого иона рассчитывали коэффициент диффузии D по формуле Эйнштейна:
![]() (1)
(1)
где τ – время опытов (τ
= 365х24x3600с).
Коэффициент
диффузии рассчитывали для трех температур (D278, D298, D318), а по ним, с использованием формулы:
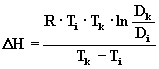 (2)
(2)
Рассчитывали
энергии разрушения (образования) кристаллических решеток соединений ионов
металлов с кластерами образцов, в которые проходила диффузия. Результаты расчетов
приведены в табл. 1 и 2.
Вместе с тем, были произведены расчеты величин ∆H квантово-химическим методом. При расчетах учитывали различие в относительной поляризующей способности ионов металлов с учетом их чисел гидратации по формуле:
![]() (3)
(3)
где Z - заряд иона, r - ионный радиус, n - число гидратации.
Внесение в
математический аппарат величины (3) позволяет рассчитывать реальную энергию
формирования (разрушения) кристаллических решеток координационных соединений,
содержащих Li+, Na+, К+, Rb+, Сs+, Са2+, Sr2+, Ba2+.
Квантово-химические
расчеты энергий формирования соединений проведены с использованием программы GAMESS (US),
предназначенной для теоретического изучения свойств химических систем
полуэмпирическим РМЗ методом с полной оптимизацией геометрии имеющихся
структур.
Важной
особенностью адсорбционных взаимодействий является тот факт, что
адсорбирующаяся молекула взаимодействует не с одним центром на поверхности
изучаемого материала, а со многими соседними центрами, поэтому при
квантово-химическом моделировании изучаются всевозможные варианты образующихся
систем, что позволяет выяснить структуры устойчивых адсорбционных комплексов и
их энергетические характеристики, по которым можно судить о механизме
формирования или разрушения соединений.
Расчетные
величины энергий формирования адсорбционных комплексов (∆Hрасч, кДж/моль) получены как разность сумм полных
энергий моделей конечных и начальных структур. Наиболее вероятными мишенями
(точками атаки) являются те элементы структур, энергия взаимодействия которых с
атакующим агентом имеет минимальное значение. Такими структурами являются
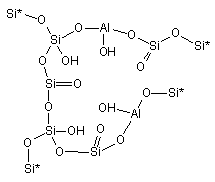
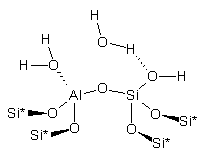
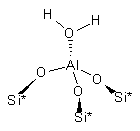
кластеры 1-4.
|
1. |
2. |
|
3. |
4. |
Таблица 1
Энергия образования (кДж/моль) связей в системе «гидратированный ион
металла-кластер алюмосиликата» по данным квантово-химических расчетов (∆Нрасч) и по
результатам изучения диффузии при температурах 278К, 298К и 318К (∆Нэксп)
|
Ион |
Относительный поляризационный потенциал |
-∆Нрасч, кДж/моль |
∆Нэксп, КДж/моль |
|||
|
Кл-1 |
Кл-2 |
Кл-3 |
Кл-4 |
|||
|
Li+ |
0,50 |
6,25 |
8,10 |
8,50 |
16,10 |
15,34 |
|
Na+ |
0,40 |
5,45 |
6,15 |
7,35 |
13,10 |
12,50 |
|
К+ |
0,32 |
15,95 |
16,10 |
20,50 |
48,50 |
47,70 |
|
Rb+ |
0,31 |
16,10 |
18,15 |
20,05 |
47,80 |
46,53 |
|
Сs+ |
0,29 |
17,10 |
17,50 |
19,20 |
45,65 |
43,35 |
|
Ве2+ |
0,75 |
14,10 |
14,35 |
15,15 |
40,35 |
42,55 |
|
Мg2+ |
0,70 |
14,50 |
15,10 |
15,20 |
20,10 |
21,52 |
|
Са2+ |
0,66 |
15,60 |
16,20 |
16,50 |
18,50 |
19,80 |
|
Sr2+ |
0,61 |
14,80 |
15,20 |
15,10 |
16,25 |
15,40 |
|
Ba2+ |
0,56 |
8,65 |
10,35 |
10,50 |
11,75 |
10,98 |
Таблица 2
Энергии образования (кДж/моль) связей в системе «гидратированный ион
металла-кластер бетона, глины, карбоната кальция или кварцевого песка» по
данным
квантово-химических расчетов (∆Нрасч)
и по результатам изучения диффузии при
температурах 278К, 298К и 318К (∆Нэксп)
|
Ион |
∆Н, кДж/моль Бетон |
∆Н, кДж/моль Глина |
∆Н, кДж/моль Песок |
∆Н, кДж/моль Карбонат кальция |
||||
|
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
|
|
Li+ |
13,90 |
12,48 |
31,50 |
32,35 |
24,20 |
25,50 |
21,50 |
20,80 |
|
Na+ |
12,85 |
13,35 |
22,10 |
24,50 |
17,15 |
15,10 |
17,80 |
15,20 |
|
К+ |
39,50 |
47,69 |
28,50 |
29,10 |
28,50 |
29,25 |
24,85 |
25,10 |
|
Rb+ |
39,20 |
45,10 |
28,10 |
28,50 |
27,80 |
27,25 |
23,90 |
24,50 |
|
Сs+ |
38,85 |
43,55 |
27,70 |
28,10 |
24,45 |
25,20 |
23,10 |
22,45 |
|
Ве2+ |
35,50 |
33,65 |
27,20 |
29,10 |
26,70 |
28,50 |
23,80 |
23,50 |
|
Мg2+ |
20,25 |
19,79 |
43,10 |
45,72 |
20,25 |
19,20 |
19,25 |
18,25 |
|
Са2+ |
- |
- |
27,50 |
26,10 |
12,15 |
10,75 |
- |
- |
|
Sr2+ |
- |
- |
26,35 |
25,50 |
11,55 |
8,75 |
- |
- |
|
Ba2+ |
- |
10,25 |
24,10 |
22,50 |
10,85 |
8,50 |
- |
- |
Как видно из
табл. 1 и 2, наиболее прочные соединения с геологическими породами и
материалами строительных конструкций образуют ионы, имеющие вакантные
электронные d-орбитали (К+, Rb+, Сs+), что очень важно для создания средств и
методов ликвидации очагов радиоактивного заражения. Также достаточно устойчивые
структуры образуют и ионы Be2+, Mg2+ и Sr2+.
Выводы
Экспериментально
изучена диффузия ионов Li+, Na+, К+, Rb+, Сs+, Са2+, Sr2+, Ba2+ сквозь геологические породы и элементы
строительных конструкций.
Учет гидратации
ионов при квантово-химических расчетах приводит к реальным термодинамическим
величинам. Все расчеты энергии взаимодействия алюмосиликатов с ионами металлов Li+, Na+, К+, Rb+, Сs+, Са2+, Sr2+, Ba2+ приведены впервые.
Ионы К+,
Rb+, Сs+, Ве2+, Мg2+ формируют с кластерами алюмосиликатов соединения повышенной прочности,
которые устойчивы в водных растворах в присутствии значительного количества ионов
Li+, Na+, Са2+, Sr2+, Ba2+ и анионов Сl и SO42-. Результаты работы могут быть использованы дл
удаления из воды устойчивых изотопов К+, Rb+, Сs+, Sr2+.
Литература
1.
Алыков Н.М., Евсина Е.М. Математическое моделирование аэродинамических
систем при создании средств очистки атмосферного воздуха / под ред. Н. М.
Алыкова. – Астрахань.: изд. дом «Астраханский университет». – 2009. – 95 с.
2.
Некрасов Б.В. Общая химия. – в 2-х томах. – том 1. – М.: Химия. – 1970. –
750 с.