Медицина/8. Морфология
к.м.н. Купша
Е.И., к.м.н. Бондаренко В.В.
Государственное учереждение “Крымский государственный медицинский университет
имени С.И. Георгиевского”, АР Крым, Украина
Случай эритрофагии гепатоцитами при поступлении в организм мышей ацетата
свинца и введении α-токоферола.
Соединения свинца оказывают выраженный токсический
эффект на систему эритрона. Связываясь с фосфатидилхолином плазмолеммы
эритроцитов и изменяя липидный состав, свинец способствует нарушению
целостности, проницаемости и функции цитоплазматической мембраны и увеличивает ее
восприимчивость к ПОЛ [1]. Взаимодействуя с оксигемоглобином, а также блокируя активность
дегидратазы δ-аминолевулиновой кислоты, принимающей участие в синтезе
гема, свинец индуцирует окислительный стресс с последующим пероксидативным
гемолизом эритроцитов и развитием анемии [1, 2]. Ионы
свинца активируют K(+) каналы эритроцита, что
приводит к его сморщиванию [3]. Перемещенный наружу фосфадилсерин распознается макрофагами,
которые поглощают и разрушают поврежденные эритроциты. Сморщивание эритроцита и
фосфадилсериновая экспозиция рассматриваются как подражание апоптозу
ядросодержащих клеток. Пусковые механизмы эриптозиса способствуют развитию
анемии. С другой стороны эриптозис, возможно, является механизмом ограничения
гемолиза дефектных эритроцитов [4]. Эритрофагоцитоз макрофагами печени, возможно,
связан с изоляцией железа, высвобождающегося из гемоглобина эритроцитов, имеющих
повышенную хрупкость мембраны. Эта защитная реакция снижает накопление железа в
печени и развитие в ней фиброза [5].
Свинцовая интоксикация моделировалась нами на 6
половозрелых самцах белых мышей линии balb/c, которым, начиная с 1-месячного возраста, ежедневно
перорально вводили ацетат свинца в дозе 10 мг/кг/сутки и масляный раствор
альфа-токоферола ацетата в дозе 2 мг/кг в течение 90 суток.
Интересной находкой является обнаружение нами не
характерной для обычно функционирующих гепатоцитов фагоцитарной активности в
отношении красных форменных элементов крови. В просвете некоторых синусоидных капилляров
выявлялись гепатоциты, подвергшиеся десквамации. При этом цитоплазма клеток
паренхимы содержала плотно упакованные конгломераты эритроцитов (рис. 1).
Гепатоциты же в составе печеночных балок имели светооптические признаки
некроза, вакуольной и жировой дистрофии.
![]()
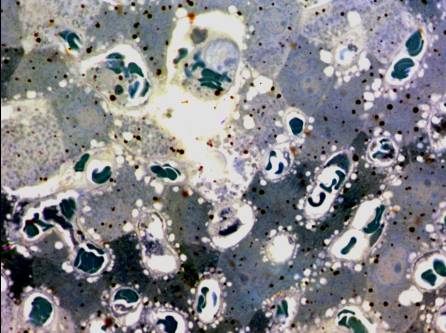
Рис. 1. Фрагмент дольки печени. В просвете капилляра визуализируется гепатоцит, содержащий в цитоплазме ассоциацию эритроцитов (стрелка). В остальных капиллярах – стаз и сладж эритроцитов. Полутонкий срез. Толуидиновый синий. Ув. х 400.
Наши наблюдения косвенно согласуются с мнением авторов,
считающих, что в результате свободнорадикального повреждения плазмолемма и
гемоглобин эритроцитов подвергаются таким аномальным структурным перестройкам,
что они легче распознаются для последующей элиминации. При этом, в процесс
поглощения одних клеток другими, кроме типичных фагоцитов, вовлекаются и эпителиоциты
паренхимы печени [4]. Можно полагать, что избыточная свинцовая нагрузка на
организм трансформирует функциональную активность гепатоцитов и задействует их
в роли своеобразных помощников клеткам Купфера. Перегруженные чужеродными
тканевыми структурами гепатоциты теряют межклеточные контакты внутри балок, отсоединяются
от них и уносятся с током крови.
Применение в эксперименте альфа-токоферола, как
антиоксиданта первой линии защиты, при длительном поступлении малых доз ацетата
свинца не предохраняет эритроциты от повреждения. Как срыв процессов адаптации
(со стороны эритроцитов) и вырожденную компенсаторную реакцию (со стороны
клеток паренхимы) мы расценивали приобретение гепатоцитами не свойственной им
функциональной способности к фагоцитозу эритроцитарных ассоциатов. При этом
имеющий место фагоцитоз не получает логического завершения – лизиса
фагоцитированного объекта.
Литература:
1. Gurer H. Can antioxidants be beneficial in
the treatment of lead poisoning? / Н. Gurer, N. Ercal // Free Radic Biol
Med. – 2000. – Vol.29,
№10. – Р.927-945.
2. Ercal N. Toxic metals and oxidative stress
part I: mechanisms involved in metal-induced oxidative damage
/ N.
Ercal, Н. Gurer-Orhan, N. Aykin-Burns //Curr. Top Med Chem. – 2001. – Vol.1. – Р. 529-539.
3. Daniela S. Kempe. Stimulation of erythrocyte
phosphatidylserine exposure by lead ions / Daniela S. Kempe, Philipp A. Lang,
Kerstin Eisele, Barbara A. Klarl et al// Am
J Physiol Cell Physiol. – 2005. – Vol. 288 – P. 396–402.
4. Lang K.S. Mechanisms of suicidal erythrocyte
death / Lang K.S, Lang P.A, Bauer C., Duranton C., Wieder T., Huber S.M., Lang F.//
Cell Physiol Biochem. – 2005. – Vol. 15 – P. 195–202.
5. Otogawa K. Erythrophagocytosis
by Liver Macrophages (Kupffer Cells) Promotes Oxidative Stress, Inflammation,
and Fibrosis in a Rabbit Model of Steatohepatitis Implications for the Pathogenesis
of Human Nonalcoholic Steatohepatitis / Kohji Otogawa, Kohji Kinoshita, Hideki
Fujii, Masahide Sakabe et al// Am J
Pathol. – 2007. – Vol. 170, №3 – P. 967–980.