Биологические науки / 9.
Биохимия и биофизика
К.т.н. Капустян А.И.
Одесская национальная академия пищевых технологий, Одесса
Получение и характеристика иммобилизованных форм
продуктов ферментолиза клеточных стенок
бактерий Lactobacillus aсidophilus
На сегодняшний день, ввиду возрождения клинического интереса к лечебно-профилактической
нутритивной поддержке населения с
иммунодефицитными состояниями, существует необходимость
своевременного и адекватного обеспечения данной категории людей функциональными
ингредиентами. Учитывая тот факт, что количество населения с расстройствами
функций иммунной системы с каждым годом растет – задача создания ингредиентов
для функциональных продуктов питания, обладающих иммунотропной активностью особенно
актуальна.
Перспективными
в этом отношении являются вещества
мурамилдипептидного ряда. Мурамилдипептид (МДП) – компонент пептидогликанов
клеточной стенки бактерий (рис.1), обладает мощным иммуностимулирующим действием.
МДП и его производные вызывает адъювантный эффект, обладает способностью
стимулировать антиинфекционную резистентность, противоопухолевый иммунитет,
активировать иммунокомпетентные клетки [1-3]. Благодаря этим свойствам продукты деградации гликопептидов бактериальной клетки привлекают пристальное внимание исследователей как потенциальные компоненты лекарственных и лечебно-профилактических средств.
|
|
|
|
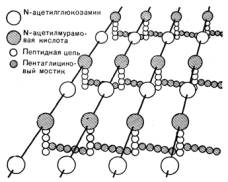
Рис.
1. Схематическое изображение структуры пептидогликана клеточной стенки. |
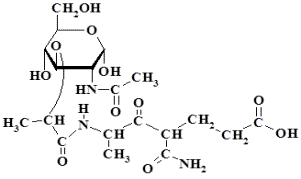
Рис.2. Структура
N-ацетилмурамил-L-аланил-D-изоглутамина (МДП) |
Остов
молекулы пептидогликана – дисахарид. Его образуют N-ацетил-глюкозамин и
N-ацетилмурамовая кислота, соединённые через гликозидные связи. К молекуле
N-ацетилмурамовой кислоты присоединяются олигопептиды, образующие боковые
цепочки. Путем деструкции пептидогликана получают МДП (рис. 2).
В качестве
источников веществ мурамилдипептидного ряда целесообразно использование
грамположительных бактерий (например, род Lactobacillus,
Bifidobacterium, Streptococcus и др.), доля пептидогликанов в клеточных
стенках которых составляет до 70 % от сухой массы [5,7]. При этом доказано,
что использование препаратов из целых микробных клеток является малоэффективными.
В связи с этим существует необходимость деструкции бактериальных клеток, или
создания синтетических аналогов МДП, с целью получения иммунотропных
биологически активных веществ (БАВ), способных легче усваиваться и вступать в
биохимические процессы, ускоряя ожидаемый иммунотропный эффект.
Разрушение
клеточных стенок бактерий можно осуществлять с помощью различных
физико-химических и биохимических методов [4]. По сравнению с
химическими технологиями, биохимический (ферментативный) способ разрушения
клеточных стенок бактерий обладает существенными преимуществами, главными из
которых являются: доступность и простота проведения, незначительная
энергозатратность и экологическая безопасность.
В качестве
ферментов, как средств разрушения клеточной стенки, чаще всего используют протеазы
(трипсин, химотрипсин, пепсин) или лизоцим.
Выбор именно
этих ферментов аргументируется тем, что они гидролизуют специфические связи,
которые присутствуют в составе биополимеров клеточной стенки бактерий. Так, лизоцим
катализирует разрыв β-(1→4) гликозидных связей между
N-ацетилглюкозамина и N-ацетилмурамовой кислотой, а протеазы – пептидных связей
между мурамовой кислотой в параллельных цепях (рис. 1, 2).
Однако было обнаружено, что
МДП обладает достаточно высокой пирогенностью и быстро выводится из организма
вследствие высокой гидрофильности [1]. В связи с этим целесообразной является модификация,
или иммобилизация МДП и его производных для
получения апирогенных веществ мурамилдипептиного ряда с возможной пролонгацией
их действия.
В качестве матриц для
иммобилизации продуктов деградации бактериальной стенки особого внимания
заслуживают биополимерные полиэлектролитные комплексы (ПЭК), получаемые по
принципу кооперативной электростатической самосборки. Включение биологически
активных веществ в ПЭК обеспечивает их стабилизацию и пролонгацию действия. При
выборе компонентов для таких систем, предпочтение отдается природным биополимерам,
обладающим высокими функциональными свойствами, способностью к биодеградации, а
также биосовместимостью с активной составляющей.
Цель настоящего исследования –
получение и характеристика иммобилизованных в ПЭК хитозан-пектин продуктов
ферментативной деградации клеточных стенок бактериальной массы Lactobacillus aсidophilus.
Ферментативный гидролиз
проводили после предварительной инкубации водной суспензии бактериальной массы
при 100 °С на протяжении 20 – 120 мин. Для приготовления
ферментной композиции использовали 0,1 – 1,0 %-ные растворы трипсина и
лизоцима в соотношении 1: 1. Гидролиз субстрата проводили при рН 7,5 и 37 °С,
что соответствовало оптимумам действия ферментов [4].
Главным критерием
эффективности разрушения клеточной стенки бактерий было получение максимального
количества биологически активных низкомолекулярных продуктов гидролиза – аминокислот,
низкомолекулярных пеп-тидов и аминосахаров.
Установлено, что максимальное
накопление аминосахаров (0,09 мг/мл) и биологически активных пептидов (3,31
мг/мл) в ферментолизате имеет место в случае предварительной инкубации водной
суспензии Lactobacillus aсidophilus
при 100 °С в течении 60 мин, соотношении ферментная составляющая:субстрат
1:20 и длительности прцесса ферментолиза – 18 час.
Иммобилизацию полученного
ферментолизата в ПЭК осуществляли путем последовательного сочетания растворов
пектина (полианион, степень деметоксилирования 67 %), ферментолизата и хитозана
(поликатион, степень ацетилирования 37 %). Концентрацию полисахаридов
варьировали в интервале 0,25 – 2,0 %, ферментов – 0,25 –
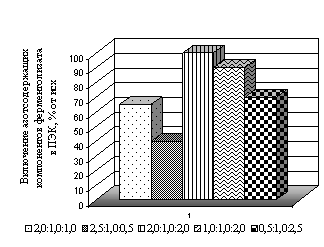
1,0 %. Количество включенного ферментолизата определяли по разнице
исходных азотсодержащих веществ ферментолизата и остаточным количеством их в
надосадочной жидкости после комплексообразования (рис. 3).
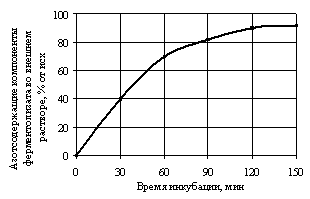
С целью прогнозирования
степени пролонгации высвобождения биологически активных веществ в составе
ферментолизата из биополимерной полиэлектролитной матрицы, изучена динамика их
диффузии во внешней раствор. Степень диффузии определяли путем фиксации
содержания озотсодержащих веществ во внешнем растворе (рис. 4).
|
|
|
|
Рис. 3.
Содержание азотсодержащих компонентов ферментолизата в трехкомпонентном комплексе
хитозан-ферментолизат-пектин (концентрация
полисахридов 0,5 %) |
Рис. 4.
Динамика диффузии азотсодержащих компонентов ферментолизата из ПЭК во внешней
раствор |
Как видно из
рис. 3, практически полная иммобилизация продуктов деградации бактериальных
стенок в комплекс имеет место при равном соотношении хитозан:пектин, что соответствует
и комплементарному соотношению свободных функциональных групп в молекулах полисахаридов.
Зависимость
приведенная на рис. 4 показывает, что имеет место тенденция замедления диффузии
азотсодержащих компонентов ферментолизата из ПЭК во внешний раствор.
Таким
образом, осуществлена деградация клеточных стенок бактериальной массы Lactobacillus aсidophilus ферментативным способом и получены низкомолекулярные продукты
ферментолиза – петиды, аминокисоты, аминосахара. Проведена иммобилизация полученного
ферментолизата в ПЭК хитозан-пектин, которая обеспечивает его пролонгированное
высвобождение. Это позволяет прогнозировать использование полученных комплексов
в качестве перспективных ингредиентов функциональных продуктов питания для
населения с расстройствами иммунной системы.
Литература.
1. Пинегин Б.В. Препараты мурамилдипептидного ряда – иммунотропные
лекарственные средства нового поколения / Б.В.Пинегин, Т.М.
Андронова, М.И. Карсонова // INTERNATIONAL JOURNAL ON IMMUNOREHABILITATION, No 6, Р. – 34.
2. Сенченко С.П. Изучение
состава препарата, полученного на основе гидролизата молочнокислых бактерий /
С.П. Сенченко, В.А. Самойлов, Н.М. Гостищева, Г.В. Сеньчукова, М.В. Гаврилин //
Хим. – фармац. журн. – Т.39, №3. – 2005. – С. 51-53
3. Пат. на корисну модель
RU (11) 2304167 (13) C2 (51) МПК C12P21/00 (2006.01) Способ поучения
гликопептидов и гликопептидный продукт, полученный этим способом, дя
использования в медицине / Ермолаев Е, Д., Софронова О. В., Орлов Н. С.,
Полякова Л. Л., Пешкова Л. М.// Заявитель: Общество с ограниченной ответственностью "МЕДБИОФАРМ-БИОТЕХ". –
Заявка: 2005128653/13,
15.09.2005; опубл. 20.03.2007
4. Телишевская Л.Я.
Белковые гидролизаты. Получение, состав, применение / Л.Я. Телишевская //
Аграрная наука, Москва. – 2000.
5. Гаврилин В.М. Выбор
оптимальных условий получения гидролизатов молочнокислых бактерий
термокислотным способом / М.В. Гаврлин, Г.В. Сенчукова, С.П. Сенченко, В.А.
Самойлов, Н.А. Гостищева // Хим. – фармац. журн. – Т.41, №2. – 2007. – С. 54-56
6. Самойлов В.А. Изучение
состава препарата, полученного на основе гидролизатов молочнокислых бактерий /
В.А. Самойлов, Н.А. Гостищева Г.В. Сенчукова, М.В.Гаврлин, С.П. Сенченко // Хим. – фармац. журн. – Т.39,
№3. – 2005. – С. 51-53.
7. Гаранян Г.С. Химическое
обоснований и биологическое исследование гидролизата на основе культур
молочнокислых бактерий / Г.С.Гаранян, Р.А. Ханферян, Э.Т. Оганесян // Хим. –
фармац. журн. – Т.44, №8. – 2010. – С. 46-49.