Белевцов Ю.П., Васильева
И.М., Жуков В. И., Наконечная О.А.,
Полозов С.Д., Гончар
В.Ю.
Харьковский национальный
медицинский университет
ИЗМЕНЕНИЯ НЕКОТОРЫХ
ПОКАЗАТЕЛЕЙ УГЛЕВОДНОГО ОБМЕНА У БОЛЬНЫХ С АДЕНОКАРЦИНОМОЙ ЖЕЛУДКА
В настоящее время, рак желудка (РЖ) занимает в
мире четвертое место по встречаемости и второе место по смертности среди
онкологических заболеваний и продолжает прогрессировать и сейчас. Ежегодно
регистрируется 798 тыс. (9,9%) новых случаев и 628 тыс. (12,1%) смертей.
Согласно данным проекта GLOBOCAN 2008, результаты которого были представлены в
2010 г, международным агентством исследований рака, самая высокая
заболеваемость и смертность по-прежнему регистрируется в странах Восточной
Азии. Около 40% случаев выявляется в Китае, где рак желудка – самая частая
форма опухоли у лиц обоего пола. Высока заболеваемость в Японии (77 случаев у
мужчин и 33 случая у женщин на 100 тыс. населения), в Восточной Европе и
тропической части Южной Африки. В США и Западной Европе эти показатели заметно
ниже [10, 11]. В Украине в 2011 году зарегистрировано 32 случая заболевания на
100 тыс. населения, 70% больных с впервые установленным диагнозом умерли на
протяжении первого года. Чаще заболевание встречается у мужчин в возрасте от 30
до 74 лет, но и среди женщин имеется тенденция к увеличению частоты данной
патологии [1].
Вышеупомянутый уровень летальности от
аденокарциномы желудка (АКЖ) напрямую связан с особенностями прогрессирования и
эволюции злокачественного процесса, который может быть осложнен анемией, флегмоной,
перфорацией, кровотечением, развитием полиорганной недостаточности, а также
метастатическим поражением других анатомических образований [4,7,12].
Предрасполагающими факторами для развития данной
патологии может быть хронический гастрит, язвенная болезнь желудка и
двенадцатиперстной кишки, алкоголизм, несбалансированное питание, употребление
в пищу недоброкачественных продуктов, содержащих токсины с канцерогенной
активностью, наследственная предрасположенность, перенесенные операции на
органах брюшной полости, (в частности желудок, пищевод, двенадцатиперстная
кишка), неудовлетворительное экологическое состояние окружающей среды, условий работы
и проживания [8].
В настоящее время в мире проводятся
многочисленные исследования по изучению этиологии и патогенеза рака желудка.
Вероятно, в основе развития механизмов опухолевого процесса лежат нарушения
многочисленных сигнальных клеточных систем, обеспечивающих регуляцию жизненного
цикла, дифференцировку и пролиферацию клеток, что приводит к злокачественной трансформации
ткани и дальнейшей ее прогрессии [2,3]. Вполне логично будет предположить, что
данные нарушения в клетке могут привести и к существенным изменениям
метаболизма, как тканевого, так и на уровне целостного организма.
Известно, что интенсивность клеточного
анаболизма в опухолевой ткани существенно повышена, а любой синтетический
процесс всегда энергозатратен, поэтому исследование процессов энергетического
обмена может углубить представление о механизмах развития рака. По мнению
нобелевского лауреата Отто Варбурга основным энергетическим субстратом для
опухолевой клетки являются углеводы. Он доказал, что пути синтеза
макроэргических соединений, а именно аденозинтрифосфата (АТФ) в злокачественной
ткани проходят через процессы анаэробного оксиления глюкозы. Вероятно, из этого
следует, что у больных онкологической патологией, в частности АКЖ, будут иметь
место изменения со стороны углеводного обмена, хотя подобные нарушения могут
наблюдаться и при таких патологических состояниях, как сахарный диабет, различные
гликогенозы, врожденные энзимопатии (галактоземия, фруктоземия). По мнению некоторых
авторов, мониторинговыми показателями интенсивности течения энергетического
обмена могут выступать некоторые ферменты (лактатдегидрогеназа, энолаза, фосфофруктокиназа
и. т.д.) [5]. Наибольшее клиническое применение в диагностике, среди
вышеперечисленных ферментов, нашла лактатдегидрогеназа (ЛДГ). Изменение её активности,
преимущественно со стороны определенной изоформы, в крови обычно
свидетельствует об остром процессе разрушения клеток. Например, при повышении
ЛДГ1,2, имеет место инфаркт миокарда, а при увеличении ЛДГ4,5 –
массовая гибель гепатоцитов. Также имеются сведения об изменениях активности
данного фермента при онкологических заболеваниях [9]. Анализ научной литературы
выявил дефицит фактических данных об особенностях углеводного обмена у больных
АКЖ, что указывает на актуальность данного вопроса.
Целью работы являлось изучение состояния референтных
уровней оценочных мониторинговых показателей состояния углеводного обмена у
больных АКЖ и обоснование прогностических критериев диагностики степени тяжести
патологии.
Материалы и методы исследования.
Под наблюдением находилось 50 пациентов (мужчин
и женщин) в возрасте от 30 до 74 лет, проходивших обследование и лечение на
базе Харьковского областного онкологического центра, из которых, у 10 больных
была диагностирована язвенная болезнь, и у 40 больных был клинически и
гистологически подтвержден диагноз АКЖ второй, третей и четвертой стадии
заболевания. Группа сравнения была представлена условно-здоровыми пациентами, аналогичного
возраста и пола не предъявляющих особых жалоб на состояние здоровья (21
пациент). Вторая, третья и четвертая стадия были определены соответственно у 10,
15 и 15 пациентов. Все больные на момент постановки диагноза не получали
противоопухолевую терапию.
Программа исследования предусматривала в первые
- третьи сутки после госпитализации определение в сыворотке крови содержания
глюкозы, лактатдегидрогеназы (ЛДГ), энолазы и ионов магния (Mg2+). Для
исследования глюкозы, Mg2+ и ЛДГ применялся биохимический анализатор
Cobas Mira, а для определения активности энолазы применялся иммуноферментный
метод и набор реактивов фирмы “NSE-ИФА-Бест”. Результаты
исследования были статистически обработаны с применением дисперсионного
анализа, коэффицента Стьюдента, корреляции и регрессии [6].
Результаты и их обсуждение.
Результаты исследования показали значительное
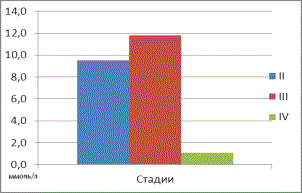
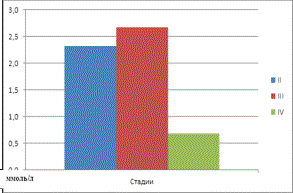
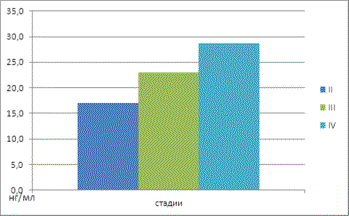
изменение углеводного обмена у больных АКЖ. На второй стадии заболевания
отмечалось повышение концентрации глюкозы на 116%, ионов Mg2+ на
137% , активности энолазы на 137,5% в
сравнении с референтными уровнями условно-здоровой группы пациентов (табл. 1). На
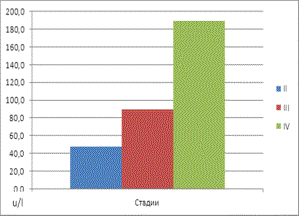
третьей стадии прогрессирования злокачественного процесса наблюдалось повышение
концентраций глюкозы и Mg2+, соответственно, на 168% и 170%, и
увеличение активности энолазы и ЛДГ на 219% и 103%. На четвёртой же стадии АКЖ
наблюдалась совсем другая картина. Регистрировалось резкое
Таблица 1.
Состояние некоторых
показателей углеводного обмена у больных c аденокарциномой желудка
|
Показатель |
Группа наблюдения (M±m), n |
|||
|
Больные и их стадии АКЖ |
Условно-здоровые |
|||
|
II (n=10) |
III (n=15) |
IV(n=15) |
||
|
Глюкоза (ммоль/л) |
9,5±5,0* |
11,8±5,8* |
1,7±1,1* |
4,4±1,1 |
|
Магний (ммоль/л) |
2,3±1,1* |
2,62±1,0* |
0,7±0,2* |
0,97±0,23 |
|
Энолаза (нг/мл) |
17,1±1,1* |
23±1,4* |
28,7±2,2* |
7,2±2,0 |
|
ЛДГ (u/l) |
50,3±8,2 |
92±6,3* |
189,6±23,1* |
45,4±6,8 |
Примечание: * различия достоверные P<0,05;
|
|
|
|
Рис
1. Средние значения концентраций глюкозы в сыворотке крови у больных в зависимости
от стадии АКЖ. |
Рис
2. Средние значения концентраций Mg2+ в сыворотке крови у больных в зависимости от стадии АКЖ. |
|
|
|
|
Рис
3. Средние значения активности энолазы в сыворотке крови у больных в
зависимости от стадии АКЖ. |
Рис
4. Средние значения активности ЛДГ в сыворотке крови у больных в зависимости
от стадии АКЖ. |
снижение
концентраций глюкозы и ионов Mg2+, соответственно, на 61% и 28%, при
этом ферментативная активность энолазы и ЛДГ существенно возрастала на 299% и
317% в сравнении с показателями условно-здоровой группы пациентов. На рисунках
1, 2, 3, 4 представлены динамические колебания измеренных показателей
углеводного обмена.
Изучение корреляционных связей выявило прямую
зависимость между концентрациями глюкозы и Mg2+, где коэффициент
корреляции составил r=0,55, Стьюдента t=3,6 и уравнение
регрессии имело вид: y=0,87+0,12x; и
между активностями ЛДГ и энолазы, где коэффициент корреляции был равен r=0,8,
Стьюдента t=9 и уравнение регрессии имело вид: y=16,3+0,06x. Наличие
прямой зависимости между глюкозой и Mg2+ может объясняться важной кофакторной
ролью данного иона магния для обеспечения каталитической активности гликолитических
и других ферментов [5]. Сопряженное снижение содержания магния и глюкозы при
четвертой стадии заболевания может объясняться развитием экзогенной
недостаточности питательных веществ и исчерпанием углеводного резерва, на фоне
возможного повышения активности гликолитических ферментов. Характер прямой
корреляционной связи между энолазой и ЛДГ показывает, что интенсивность
процессов анаэробного гликолиза растет прямо пропорционально с
прогрессированием опухолевой ткани и развитием гемической и тканевой гипоксии.
Таким образом, результаты исследования показали
наличие патологических отклонений в углеводном обмене у пациентов, страдающих на
аденокарциному желудка. Данные динамические изменения в сыворотке крови
свидетельствуют об усилении процессов ферментации глюкозы, нарушении
регуляторных, кофакторных и интегративных систем, с последующим исчерпанием
углеводного резерва. Это объясняется повышенной требовательностью опухолевой
ткани к энергетическому субстрату, преобладанием катаболизма над анаболизмом и
активацией адаптационных реакций организма к развитию злокачественного новообразования.
Среди всех измеренных показателей наиболее чувствительным к прогрессированию
болезни является активность энолазы. Так, при второй, третьей и четвертой
стадии ее уровни повышаются по
сравнению с контролем, соответственно в
2,4, 3,2 и 4 раза. Из этого следует, что данный показатель можно использовать
как дополнительный прогностический критерий оценки степени тяжести клинического
течения заболевания.
Литература:
[1]
Рак в Украине, 2009-2010. Заболеваемость, смертность, показатели деятельности
онкологической службы. Бюл. Национального канцер-реестра Украины, К, 2011, 12:
108 с.
[2]
Jorrit J. Hornberg,
Frank J. Brugemann,
Hans V. Westerhoff,
Jan Lankela (2005). Cancer: A systems biology disease. Bio Centrum, Amsterdam, 2005. - P
1-10.
[3] John J. O’Shea, M. D. , Meven M. Holland, M.D., and Lavis M.
Straud, M. D. Ph. D. , JAKs and STATs in Immunity, Immunodeficiency, and Cancer
/ N Engl J Med 2013; - N 368, - p 161-170.
[4]
Моисенко М. Д. Об осложнениях рака желудка флегмоной // Вестн. хир. 1956. Т.77,
№.5. – С. 62-66.
[5]
Биохимия: учебник / под ред. Е. С. Северина. – 2-е изд., испр., - М.:
ГЭОТАР-МЕД 2004. – 784 с.
[6]
Стентон Гланц. Медико-биологическая статистика, пер. с англ. – М.,
Практика, 1998.- 459 с.
[7]
Толпинский А. П., Токарев Б. В., Бахлаев И. Е. Осложнения рака желудка / Методические
указания. - Петрозаводск, 1995. – 25 с.
[8]
Жунтова Г. В. Оценка влияния радиационных и нерадиационных факторов на
заболеваемость раком желудка у работников ПО «Маяк». Москва // Медицинская
радиология и радиологическая безопасность. - 2009. – Том 54, N 2.
– С. 38-46.
[9]
Журкина О. В. Лактатдегидрогеназа крови и мочи при доброкачественных и
злокачественных новообразований почки // Сибирский онкологический журнал. –
2008.-№1.- 25
с.
[10] Tadataka Yamada, Textbook of
gastroenterology by Tadataka Yamada, 5-th ed. – WB, 2009. – 3431 p.
[11]Ferlay J, Shin HR, Bray F et al.
Estimates of worldwide burden of cancer in 2008. GLOBOCAN 2008 // Int
J Cancer, 2010. - № 127. – P.
2893-2917.
[12]
Шаповалов С. В. Редкое осложнение рака желудка // Клин. хир, 1985. №5, С.
62-63.