утиллизация нитроэфиров
целлюлозы под воздействием микроорганизмов
Романова С.М., Трескова В.И.
Казанский
научно-исследовательский технологический университет,
Г. Казань,
ул. Карла Маркса 68, may62@mail.ru
Эфиры целлюлозы широко используются в
промышленном производстве, а нитрат целлюлозы (НЦ) занимает особое место не
только в производстве изделий народно-хозяйственного назначения, но в
обеспечении обороноспособности страны. На производстве нитроцеллюлозы
образуется большое количество сточных вод содержащих нитроцеллюлозное волокно,
которое в виде донных отложений накапливается в прудах-отстойниках. В настоящее
время они содержат до несколько тысяч тонн этого волокнистого материала.
Попадая в водоемы, сама нитроцеллюлоза в условиях средней климатической полосы в естественных условиях полностью
микроорганизмами и грибами не разлагается, либо подвергается деструкции в
небольших концентрациях [1], поэтому
разработка метода ее обезвреживания в искусственных условиях позволит снизить
отрицательную нагрузку на природную окружающую среду.
Проведенный анализ литературы показывает,
что к настоящему времени разработаны методы биологического обезвреживания
различных органических нитратсоединений. В литературе, например, описаны метод
возможного использования микроорганизмов для частичной денитрации поверхности
нитрат целлюлозы с целью улучшения контроля скорости горения реактивного
топлива, в состав которого входит нитрат целлюлоза. Найдено, что штамм бактерий
Aspergillug fumigatus
способны расти на пироксилине в питательной среде, содержащей углерод и
лишенной азота, но при этом данные микроорганизмы потребляют лишь азот нитрата
целлюлозы, не затрагивая углеродных связей [1].
Авторами [2, 3] было
предложено использовать сульфатредуцирующие бактерии штамм p. Desulfovibrio,
которые в качестве первичного звена в микробном консорциуме могут инициировать
процесс разложения нитроэфиров целлюлозы в условиях заводских стоков, снижая
степень нитрованности полимера и делая его доступным для других членов
сообщества. Так же были выделены бактерии штамм Ps. denitrificans, способные разрушать тринитротолуол,
входящий в состав порохов, при сравнительно высоких концентрациях (порядка 200
мг/л) [4]. Например, штамм Pseudomonas fluorescens ВКЛМ В-3468 (С9) селекционирован
из такого типа, выделенного из очистных сооружений предприятий органического
синтеза, и способен при 20 - 25°С в концентрации порядка 80% от количества
общей микрофлоры осуществлять на 97% деструкцию нитростирола и до 95% - нитратов
[5]. Дрожжи,
выделенные из нефтезагрязненных торфяников и отходов нефтехимии, нефтешламов,
относятся к числу доминирующих микроорганизмов в этих антропогенных местообитаниях.
Их способность выживать и доминировать в таких экстремальных условиях, в
сочетании с эффективным механизмом деградации тринитротолуола делает данные
микроорганизмы перспективными с точки зрения утилизации промышленных отходов,
загрязненных взрывчатыми веществами [6].
Согласно данным [7],
большинство аэробных бактерий осуществляют восстановление нитропроизводных до
моноаминопроизводных. Микробиологическое восстановление ONO2-групп нитрат целлюлозы может являться ключевой реакцией,
снижающей токсичность этого
вещества и открывающей
возможность его дальнейших глубоких превращений. Но так как бактерии и грибы
полностью нитраты целлюлозы не разлагают, или разлагают в небольших количествах
[1], был предложен метод предварительной химической модификации нитратов
целлюлозы гидролизом гидроксидом калия,
до более легко усвояемых для микроорганизмов веществ, с последующим биологическим
окислением активным илом в не токсичные соединения.
В данной работе мы предлагаем
утилизировать донные отложения прудов отстойников в два этапа:
1)гидролиз нитрат целлюлозы до простых веществ, доступных для микроорганизмов
веществ;
2)последующее биологическое окисление
активным илом.
В отличие от целлюлозы,
которая неустойчива к действию растворов щелочей, нитрат целлюлозы очень
чувствителен к щелочным обработкам и при
этом легко омыляется. В зависимости от природы реагента, в большей или меньшей
степени также протекают и процессы, обуславливающие разрыв пиранозного цикла и
образования низкомолекулярных соединений.
Реакционная способность нитрат целлюлозы
определяется наличием трех видов функциональных группировок: нитратной,
ацетальной и гидроксильной (для не полностью этерифицированных образцов). Для
гидролиза важны только первые две. При этом разрушение ацетальной группировки
приводит к деструкции нитрат целлюлозы [8].
При действии щелочи наблюдалось ускорение
процесса, которое увеличивалось с ростом концентрации КОН и, по-видимому, было связано с реакционной способностью щелочи к
автокаталитическими явлениями. Общая особенность всех видов гидролиза – отсутствие
влияния на скорость денитрации природы исходной целлюлозы, содержание азота в
образце нитрат целлюлозы и его удельной поверхности [9]. Отсутствие влияния
удельной площади поверхности (Sуд) образца свидетельствует о том, что роль реакции на поверхности
нитрат целлюлозы ничтожна и процесс идет в основном внутри волокна. Проникновение
воды, кислоты, щелочи в объем вещества происходит быстро. Этому соответствуют
коэффициенты диффузии воды в нитрат целлюлозу (10-7 – 10-6
см/с) [10].
Взаимодействие нитрат целлюлозы с гидроксидом калия проводили в водной гетерогенной среде, так
как основная особенность химических превращений
нитрат целлюлозы заключается в важной роли не только законов собственно
химической реакции, но и массопереноса реагента и образующихся продуктов.
Реакцию проводили по схеме [11]:
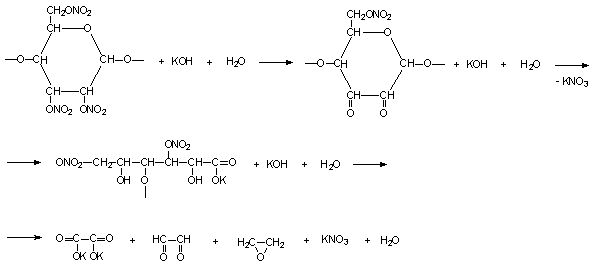 Рис. 1- Схема
реакции взаимодействия нитрат целлюлозы с гидроксидом калия
Рис. 1- Схема
реакции взаимодействия нитрат целлюлозы с гидроксидом калия
Кетонная группировка обеспечивает разрыв
связи С–С и разрушение нитрата с отщеплением NO2-.
Щелочной гидролиз нитрат целлюлозы протекает как с концов макромолекулы, так и
с разрывом цепи. Вклад обоих процессов в измеряемую скорость деструкции
приблизительно одинаков.
Реакции гидролиза проводили при температурах, когда самопроизвольный
распад практически не идет. Наиболее полная деструкция нитрата целлюлозы под
действием гидроксида калия произошла при концентрации 3 г/л и ниже (см. табл.
1), при температуре 97°С и времени 90 минут, о чем свидетельствовало отсутствие
осадка, так все продукты реакции стали растворимы в воде.
Таблица 1 – Результаты щелочного гидролиза НЦ едким
кали
|
Концентрация НЦ, г/л |
Температура реакции, °С |
Время реакции, минутах |
ХПК продуктов гидролиза, мгО2/л |
|
0,01 |
97 |
90 |
2433 |
|
0,1 |
97 |
90 |
4337 |
|
0,2 |
97 |
90 |
8975 |
|
1 |
97 |
90 |
12851 |
|
1,7 |
97 |
90 |
18634 |
|
3,3 |
97 |
90 |
30550 |
Производили измерение показателя ХПК гидролизата с целью контроля за полнотой проведения
процесса гидролиза нитрат целлюлозы. Для анализа бралась только жидкая фаза.
Рост показателя ХПК с увеличением
концентрации нитрат целлюлозы, говорит о том, что нитрат целлюлозы полностью
гидролизовался при данных условиях (см. табл. 1), и весь в виде водорастворимых
продуктов реакции перешел в раствор, следовательно, нитрат целлюлозы полностью
деструктировался до легкоокисляемых и доступных для микроорганизмов соединений.
После гидролиза нитрат целлюлозы до более
легко усвояемых для микроорганизмов веществ мы
провели биологическое окисление полученного гидролизата.
Биологическое окисление продуктов гидролиза НЦ вели в аэробных
условиях. Для биологического окисления были взяты растворы с исходной
концентрацией нитрата целлюлозы 0,1 и 0,2 г/л, так как после биологического
окисления растворов с большей концентрацией нитрата целлюлозы ХПК полученных
растворов гидролизата имеет значения выше
предельно допустимых норм для воды водных объектов имеющих рыбохозяйственное
значение (СанПиН
2.1.5.980-00.).
Результаты исследований фильтрата после
биологического окисления занесены в таблицу 2.
Таблица 2 – Результаты
исследования фильтрата после биологической деградации гидролизата нитрат целлюлозы
|
Концентрация НЦ в исходном растворе до реакции
гидролиза, г/л |
Время биологического окисления, минуты |
Светопропускание Т, % |
Оптическая плотность D,отн.ед. |
ХПК, мгО2/л |
|
|
15 |
89 |
0,050 |
693,2 |
|
|
30 |
91 |
0,045 |
568 |
|
|
45 |
92 |
0,040 |
444 |
|
0,1 |
60 |
94 |
0,022 |
165,5 |
|
|
120 |
95 |
0,020 |
51,8 |
|
|
180 |
97 |
0,016 |
24,1 |
|
|
240 |
99 |
0,012 |
15,3 |
|
|
15 |
86 |
0,060 |
800 |
|
|
30 |
90 |
0,048 |
718 |
|
|
45 |
91,5 |
0,040 |
564 |
|
0,2 |
60 |
93 |
0,024 |
200 |
|
|
120 |
95 |
0,020 |
54 |
|
|
180 |
96,5 |
0,017 |
24 |
|
|
240 |
98 |
0,014 |
17 |
По данным
эксперимента видно (см. табл. 1), что происходит падение оптической плотности и
ХПК растворов гидролизата после их биологического окисления. На основании данных
таблицы 2 была построена диаграмма (см. рис. 2), наглядно показывающая динамику
процесса биологического окисления гидролизата.

Рисунок 2– Динамика
процесса биологического окисления гидролизата нитрата целлюлозы
По диаграмме (рис. 2) видно, что
происходит падение ХПК растворов гидролизата с течением времени биологического
окисления, это свидетельствует о потреблении микроорганизмами продуктов
гидролиза нитрата целлюлозы, которые теперь находятся в легко усвояемых формах.
Приведенные данные позволяет рассматривать
биологическое окисление сообществом микроорганизмов активного ила в качестве
второго этапа - микробной утилизации неприродного полимера – нитрата целлюлозы.
Биологическая очистка отходов производства нитроцеллюлозы, в основу которой
положена биологическая деструкция гидролизата полимера активным илом, может
явиться альтернативой сжиганию и оказаться перспективой для создания
биотехнологии утилизации НЦ.
Таким образом, в данных
исследованиях был предложен метод щелочного гидролиза НЦ до более легко
усвояемых для микроорганизмов веществ с целью их дальнейшего биологического
окисления активным илом до двуокиси углерода, двуокиси азота и воды, которые
являются не токсичными соединениями. Полученные
в результате проведенных исследований результаты свидетельствуют о возможности
утилизации донных отложений прудов
отстойников с помощью активного ила.
Библиографический список
1. Brodman, B.W. Microbial attak of nitrocellulose/ Brodman B.W., Devine M.P. // J. Appl. Polym. Sci. – 1981. – V. 26.
- №3. – Р. 997 – 1000.
2. Петрова, О.Е. Трансформация нитроэфира
целлюлозы сульфатредуцирующей бактерией Desulfovibrio desulfuricans 1388: дис.
... канд. техн. наук: 03.00.07: защищена 12.01.04: утв. 25.06.04 / Петрова
Ольга Евгеневна. - М., 2004. – 114с.
3. Петрова, О.Е. Сульфатредуцирующие
бактерии в биологической переработке промышленных отходов, содержащих
нитроцеллюлозу / Петрова О.Е., Давыдова М.Н., Тарасова Н.Б., Мухитова Ф.К. //
Вестн. Моск. Ун-та. – 2003. – Т.44. - №1. – С. 43-45.
4. Зарипов,
С.А. Начальные этапы трансформации 2,4,6-тринитротолуола микроорганизмами / Зарипов С.А., Наумов А.В., Суворова Е.С., Ярусов А.В., Наумова Р.П. //
Микробиология. - 2004. - Т. 73. - № 4. - С. 472-478.
5. А.
с. 1423585 СССР, МПК C 12 N 3/34. Штамм бактерий Pseudomonas denitrificans, используемый
для биологической очистки сточных вод от ароматических соединений/ Р.П. Наумова, Н.И. Куликова, С.Ю. Селивановская,
Н.Е. Затолокин(СССР). - №
4054610/31; заявл. 05.03.1986; опубл. 15.09.1988.
6. Зиганшин, А.М. Гидридное восстановление
2,4,6-тринитротолуола дрожжами – путь к его глубокой деструкции./ Зиганшин
А.М., Наумов А.В., Суворов Е.С., Науменко Е.А., Наумова Р.П.// Микробиология. –
2007. – Т.76. - №6. – С. 766-773
7. Амерханова, Н. Н. Адсорбция гербицидов микроорганизмами./ Амерханова Н.
Н., Наумова Р. П. // Проблемы охраны вод и рыбных ресурсов Поволжья.: - Тез. докл.
конф. молодых ученых. – Казань: КГУ. - 1977. – С.123-135.
8. Закощиков, А. П. Нитроцеллюлоза / А. П.
Закощиков. - М.: Обронгиз, 1950. – 371 с
9. Лурье, Б.А. Кинетические закономерности
денитрации нитратов целлюлозы при нейтральном гидролизе / Б.А. Лурье, З.Т.
Валишина, Б.С. Светлов // Химия и технология получения нитратов целлюлозы и
пироксилиновых порохов; межвузовский сборник. Казань, 1984. – 216 с.
10. Дроздов, М.А. О снижение вязкости и
содержания азота в нитроцеллюлозе утилизируемых пироксилиновых порохов / М.А.
Дроздов, Г.Я. Гуменюк, А.В. Покровский, С.Н. Бердоносова // Журнал прикладной
химии. – 2000. – Т. 73. – Вып. 3. – С. 504-507.
11. Голицкая, И.М. Методы получения, анализа и
испытаний нитратов целлюлоз / И.М. Галицкая, В.П. Дубина, С.И. Шидяков. – М.: 1990.
– 148с.