Химия и химические технологии/5. Фундаментальные проблемы
создания новых материалов и технологий
к.х.н. Алыкова Т.В., к.х.н. Салмахаева А. М., д.х.н. Алыков Н. М.
Астраханский
государственный университет, Россия
Исследование формирования
тетрациклином, адсорбированном на силикагеле координационных соединений,
обладающих высоким светопоглощением
Сорбция тетрациклина (ТЦ) на силикагеле
КСМГ изучена в статических условиях в
интервале рН от 1 до 10. Установлено,
что сорбция ТЦ на КСМГ происходит в широком диапазоне рН от 2 до 6. Изотермы
сорбции изучены в статическом режиме при рН 3. Основные характеристики статической
сорбции ТЦ силикагелем КСМГ приведены в табл. 1.
Таблица
1
Основные термодинамические характеристики сорбции ТЦ на КСМГ
|
Константы сорбции К10-3 |
-DН, кДж/ моль |
-DG 298, кДж/моль |
DS298, Дж/моль×К |
Г¥, мг\г |
||
|
К278 |
К298 |
К313 |
||||
|
2,30 |
1,75 |
1,10 |
9,40 |
12,80 |
11,40 |
4,00 |
Результаты, приведённые в табл. 1,
свидетельствуют о высоких сорбционных характеристиках силикагеля КСМГ по
отношению к ТЦ.
Кинетика сорбции. При изучении статистической сорбции используются
значения равновесных констант сорбции, которые позволяют определить термодинамические
характеристики сорбционных процессов. Эти характеристики позволяют оценить
глубину и необратимость процесса сорбции. Но сорбционный процесс, согласно
полученным результатам (табл. 1), это хемосорбция, если учитывать, что
увеличение температуры приводит к ускорению наступления равновесия. В этом
плане необходимо изучение скорости сорбции,
что позволит определить время наступления равновесия и, кроме этого, хотя
бы ориентировочно оценить механизм
процесса формирования активированного адсорбционного комплекса.
Кинетика сорбции
тетрациклина на силикагеле КСМГ исследована методом динамических выходных
кривых. Согласно экспериментальных данных, для сорбционных процессов при
различных температурах характерен достаточно крутой начальный участок изотермы
кинетики сорбции, процесс сорбции протекает быстро и практически заканчивается
через несколько минут. Основные характеристики кинетики сорбции тетрациклина на
силикагеле КСМГ приведены в табл.2.
Таблица 2
Основные
характеристики кинетики сорбции ТЦ на силикагеле КСМГ
|
Сорбент |
- ln pZ0 |
Eакт, кДж/моль |
- DS#298, Дж/моль∙К |
|
Силикагель КСМГ |
1,75 |
9,65 |
118,9 |
Анализ результатов, полученных при
исследовании статики и кинетики сорбции, позволяет считать, что сорбция
тетрациклина на силикагеле КСМГ протекает в две стадии. Начальная стадия
взаимодействия в системе тетрациклин-сорбент – это процесс, связанный с
формированием активированного адсорбционного комплекса, сопровождающийся
отрицательным изменением DS# (табл.
2). Это означает, что начальная стадия сорбции – это односторонний процесс
закрепления ТЦ на силикагеле КСМГ. Далее активированный комплекс переходит в
более устойчивое состояние, когда происходит перераспределение связей и
вытеснение воды из координационной сферы сорбента, при этом величина DS возрастает (табл. 1).
Наряду с изучением адсорбции тетрациклина
на силикагеле КСМГ, была также изучена сорбция ионов железа на силикагеле КСМГ
на котором сорбирован тетрациклин и формирования на нём координационного
соединения, в котором один и тот же элемент находится в виде ионов с различной
степенью окисления. Известно, что такие координационные соединения обладают высоким
светопоглощением в видимом диапазоне спектра.
При pH3, оптимальном для сорбции тетрациклина на силикагеле
КСМГ, одинаково хорошо сорбируется как железо, так и тетрациклин. Вместе с тем
любой из кремнезёмов имеет силанольные и силоксановые группы, расположенные не
только по поверхности сорбента, но и в порах, в которых эти группы
располагаются по кольцу. В эти поры захватывается протонированный азот
тетрациклина, при этом образуется прочный адсорбционный комплекс. Тетрациклин
имеет возможность образовывать соединение большой прочности с железом в форме Fe2(OH)24+ с pKуст =
7,38. Это же железо с силанольными и силоксановыми группировками,
расположенными на поверхности силикагеля, образует соединение с pKуст = 3,5
– 4 и легко смывается с поверхности сорбента 0,1 M раствором уксусной кислоты. Таким образом можно
достичь того, что на поверхности силикагеля будет оставаться только комплексное
соединение железа с тетрациклином, причём количество железа эквивалентно
количеству тетрациклина.
Тетрациклин в области рН ниже 6
адсорбируется на силикагелях по механизму, который можно описать так:
протонированная диметиламиногруппа тетрациклина имеет вакантную орбиталь и легко
координируется с n-электронами силанольных и силоксановых групп
силикагеля. Если в растворе имеются ионы Fe3+, то они
вступают в реакцию с тетрациклином по гидрокси и карбонильным группам, наиболее
вероятным местом присоединения является гидроксильная группа ароматического
кольца (кольцо D) и карбонильная группа
гидроароматического кольца (кольцо C), хотя
не исключаются и другие места присоединения Fe3+ к тетрациклину.
Адсорбционный комплекс Сорбент (силикагель)
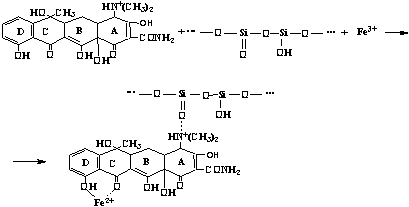
Таким образом, адсорбционный комплекс
представляет собой агрегат, содержащий в своём составе силикагель и тетрациклин
в виде его координационного соединения с Fe3+.
Fe (III) в
соединении с тетрациклином на сорбенте при взаимодействии с K4[Fe(CN)6]
образует интенсивно окрашенный комплекс, интенсивность окраски которого
меняется в зависимости от концентрации тетрациклина.
Результаты изучения сорбции тетрациклина
на силикагеле КСМГ и образование на нем окрашенного соединения в присутствии FeCl3 и K4[Fe(CN)6]
стали основой создания методики определения тетрациклина в биологических
жидкостях с использованием колористической тест-шкалы, с нижней границей
определяемых содержаний 0,024 мкг тетрациклина в пробе.
Литература
1.
Концентрирование следов
органических соединений. Серия «Проблемы аналитической химии». Т. 10.: Под ред.
Кузьмина Н.М. М.: – Наука, 1990. – 290 с.
2.
Пилипенко А.Т.,
Тананайко М.М. Разнолигандные и разнометалльные комплексы и их применение в
аналитической в аналитической химии. М.: – Химия, 1983. – 224 с.