Химия и
химические технологии/4. химико-фармацевтическое
производство
Шутов Р.В, Куклина Е.В., Ивин Б.А
Санкт-Петербургская государственная
химико-фармацевтическая академия, Россия
Исследование
синтеза и биологической активности новых производных конденсированных пирано[3,2-c]хроменов
Ранее нами было изучено взаимодействие 2-арил-4-гидрокси-6H-1,3-тиазин-6-онов с салициловыми
альдегидами [1], в результате чего образуются производные
кумарин-3-карбоксамида. Не меньший интерес представляют 3-формилхромоны, в которых
при насыщении двойной связи C2=C3 происходит образование b-формилкетонной группировки, благодаря чему они также
находят применение в синтезе гетероциклов. В то же время большинство соединений
с активной метиленовой группой образуют с формилхромоном гетерилметиленовые
производные [2]. Так как для производных 1,3-тиазина подобных исследований не
проводилось, мы изучили их реакцию с 3-формилхромонами.
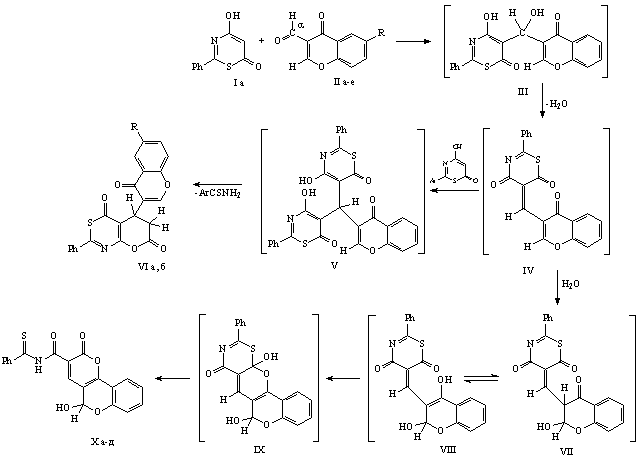
Установлено, что 2-фенил-4-гидрокси-6H-1,3-тиазин-6-оны
(I) реагируют с замещенными 3-формилхромонами (II а-е) в присутствии пиридина или в полярных апротонных растворителях (ДМСО, ДМФА), образуя смесь N-тиобензоил-5-гидрокси-2H,5H-пирано-[3,2-с]хромен-2-он-3-карбоксамидов (X а-д) и 2-фенил-5-(хромен-3-ил)-6,7-дигидро-4H,5H-пирано[2,3-d]-1,3-тиазин-4,7-дионов (VI а, б) с суммарным
выходом 50–70% (схема 1). Прослеживается совершенно
определенная взаимосвязь между соотношением продуктов (VI) и (X) и заместителем в бензольном
кольце хромона: если в случае акцепторных заместителей (Cl, Br, NO2) были обнаружены только
пиранохромены (X) с выходом
60-70%, то в случае сильного донора (OCH3) были выделены только пиранотиазины (VI) с выходом около 50%. В случае
незамещенных и 6-метилхромона была получена смесь соединений (VI) и (X) в соотношении около 1:1 (по
ПМР).
Схема 1
II, R = MeO(а), Me(б), H(в), Cl(г), Br(д), NO2(е);
VI, R = MeO(а), Me(б); X, R = Me(а), H(б), Cl(в), Br(г), NO2(д).
Происхождение обоих типов
продуктов понятно из схемы 1. Первой стадией реакции является образование
гетерилтиазинилкарбинола (III), который далее дегидратируется в
5-гетерилметилентиазин (IV). Именно на этой стадии происходит ветвление процесса: интермедиат (IV)
может присоединять вторую молекулу тиазина с образованием в конечном итоге
пиранотиазинов (VI), с другой
стороны может происходить сопряженное присоединение воды к связи C2=C3 хромона. В последнем случае
4-оксогруппа интермедиата (VII) может легко енолизироваться, стабилизируясь за счет эффективного
сопряжения с тиазиновым кольцом, и расщеплять тиазиновый цикл с образованием
пиранохроменов (X). Очевидно,
что роль заместителей осуществляется через влияние на энергетические
характеристики этих двух направлений процесса.
Строение полученных соединений
подтверждено данными ЯМР 1H и 13C, ИК, УФ и
масс-спектров. В масс-спектрах
соединений (X а-д) присутствует мало
интенсивный (Iотн.=4-7%)
пик молекулярного иона, что характерно для соединений содержащих спиртовую или
полуацетальную группу. Присутствуют также характерные для спиртов пики дочерних
ионов [M–H.]+; [M–OH.]+ с
интенсивностью 10-15%. Наиболее интенсивными являются пики фрагментов,
образующихся в результате расщепления молекулы [M–CO2]+.;
[M–CO2–ArCNH-S].; [M–CO2–ArCS–HNCO]..
Наиболее характеристичными
сигналами в спектрах ЯМР 1H соединений (XI а-з) являются синглеты
групп NH (12.5–12.9 м.д.) и C4H (8.6–8.9 м.д.), дуб-леты C5H
(7.1-7.3 м.д. J=6 Гц) и C5OH (6.5-6.6 м.д. J=6 Гц), кроме того,
присут-ствуют сигналы протонов бензольных колец хромена и тиобензоильного
фраг-мента (6.6–8.2 м.д.) с соотношением интегральных интенсивностей 1:1. В
спек-трах ЯМР 13С (табл. 4.8) характеристичными являются сигналы
атомов углеро-да карбонильной и тиокарбонильной групп (159–161 и 198–202 м.д.),
пираново-го цикла: C2 (160–162 м.д.), C3 (110–115 м.д.),
C5 (91–98 м.д.), C4 (147–149 м.д.), а также бензольных колец хромена и бензоильного
фрагмента (112–158 м.д.).
В ИК спектрах кристаллических
образцов соединений (XI а-з) наблюдаются полосы валентных колебаний связи O-H
(~3400 см-1), связей C=O (1670–1690 см-1, «амид I»; и 1720–1740,
O=C–O), а также полосы «амид II» (1535–1560 см-1) и C–O (1170-1190
см-1). В УФ спектрах
(ацетонитрил) присутствуют 2-3 максимума поглощения (210 нм, 280-300 нм и
400-450 нм).
Синтезированные
соединения малотоксичны, LD50 (метод Миллера-Тейнтера) составляет 2250 и 2450 мг/кг для соединений (X г и III д, соответственно). Вещества
проявляют умеренную противосудорожную активность.
Литература:
1. Шутов Р.В., Калужских А.Н., Москвин А.В., Ивин Б.А
// ЖОХ. 2006. Т. 76. Вып. 5. С. 850-857.
2. Gašparová R.,
Lácová M. // Molecules. 2005. Vol. 10. P. 937-960.