Химия и химические технологии/6.Органическая химия
Д.х.н., доцент Курманкулов Н.Б.
АО «Институт
химических наук им. А.Б. Бектурова», Казахстан
Новые Замещенные феноксипропаргиловые
третичные спирты пиперидинового и
циклогексанового рядов
Высокий выход,
простота проведения реакции и универсальность процесса позволяют широко
использовать реакцию Фаворского в тонком органическом синтезе как простейших по
строению ацетиленовых спиртов, так и для синтеза сложных аналогов природных
физиологически активных соединений [1–6].
В качестве модельных
замещенных феноксипропаргилов с алкильными заместителями в фенильном радикале в
реакции Фаворского использованы 2,3-диметил- и 2,6-диметилфеноксипропины 1 и 2. Взаимодействие с циклогексаноном и 1-бензилпиперидин-4-оном проводили
в классических условиях реакции Фаворского и с удовлетворительными выходами (45
– 64 %) получили соответствующие спирты 3
– 6.
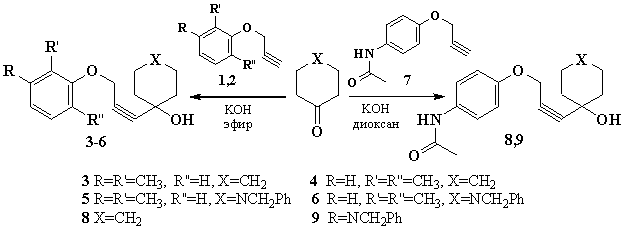
Также изучено
взаимодействие п-ацетиламинофеноксипропина
7 с указанными выше циклическими
кетонами. Так как исходный пропаргиловый эфир плохо растворим в эфире,
использовали диоксан в качестве реакционной среды. После соответствующей
обработки реакционной среды и перекристаллизации из гексана с выходами
≈50% получены 1-[3-(4-ацетиламинофенокси)проп-1-инил]циклогексан-1-ол 8 и
1-бензил-4-[3-(4-ацетиламинофенокси)проп-1-инил]пиперидин-4-ол 9.
Все спирты
характеризуются наличием в ИК спектрах уширенных полос поглощения в области
3400 – 3500 см-1, характерных для валентных колебаний гидроксильных
групп. Пики слабой интенсивности в области 2100 см-1 указывают на
наличие тройной ацетиленовой связи. В спектрах ПМР отсутствие химических
сдвигов протонов концевой ацетиленовой связи при 2,5 м.д. и проявление уширенных
синглетов для протонов гидроксильной группы указывает на протекание
нуклеофильного присоединения исходных пропаргилов по карбонильной группе
циклогексанона и бензилпиперидин-4-она.
В продолжение работ
по синтезу новых потенциальных биологически активных соединений в ряду
арилоксипропиниловых пиперидолов проведено взаимодействие пропаргиловых эфиров
различных бромфенолов с 1-метилпиперидин-4-оном в условиях реакции Фаворского
[10]. В результате нуклеофильного присоединения бромфеноксипропинов по
карбонильной группе пиперидона получены соответствующие третичные ацетиленовые
спирты 10 – 12 с выходами 82, 86 и 79 % соответственно.
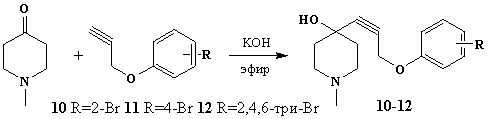
Строение
синтезированных соединений доказано методами спектроскопии ИК и ЯМР 1Н
(таблица).
На рисунке приведен
полный спектр пиперидола 12 и
фрагменты фенильной части молекул пиперидолов 10 и 11, области
спектров последних до 5,5 м.д. идентичны, приведенному на рисунке.
Данные
спектров ИК и ЯМР 1Н пиперидолов 10 – 12
|
Соеди-нение |
ЯМР 1Н, dH, м.д. |
ИК, nmax,см-1 |
|||||
|
Н при С2,6 |
Н при С3,5 |
ОСН2 |
N−CH3 |
Ar−Н |
OH |
Ph |
|
|
10 |
2,16; 2,43 |
1,66;
1,73 |
4,82 |
2,13 |
6,85
т; 7,12 д; 7,27 т; 7,47 д |
3585 |
1615,
1480 |
|
11 |
2,15; 2,42 |
1,64; 1,72 |
4,72 |
2,13 |
6,93
д; 7,22 д |
3585 |
1610,
1495 |
|
12 |
2,06; 2,41 |
1,61; 1,67 |
4,82 |
2,12 |
7,69 с |
3480 |
1615,
1490 |
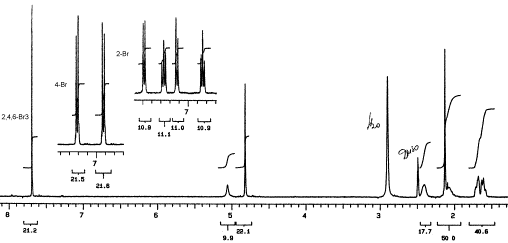
Спектр ЯМР 1Н пиперидола
12
Таким образом, нами
впервые синтезированы диметил- и п-ацетиламинопропаргиловые
циклогексанолы и бензилпиперидолы с выходами 45 – 64 %, а взаимодействием
2-бром-, 4-бром-, 2,4,6-трибромфенилоксипроп-1-инов с 1-метилпиперидин-4-оном в
условиях реакции Фаворского синтезированы новые
1-метил-4-[3-(бромфенокси)проп-1-инил]пиперидин-4-олы с выходами 79–86%.
Методами элементного микроанализа, спектроскопии ИК и ПМР доказаны состав и
строение синтезированных пиперидолов.
Литература:
1 Ержанов К.Б., Пралиев С.Д., Бутин Б.М., Курманкулов Н.Б., Куатбеков А.М.
Успехи и перспективы создания химических средств защиты и регуляторов роста
растений в Казахстане // Труды научно-практ. конф. по актуальным вопросам
химизации сельского хозяйства – Ташкент, 2002. – С.10.
2
Ержанов К.Б., Курманкулов Н.Б., Визер С.А., Ермагамбетов Р.Р., Саурбаева Б.С.,
Акимбаева Н.О., Килевая О.В., Асылханов
Ж.С. Перспективы применения результатов фундаментальных исследований в области
химии ацетилена в тонком органическом синтезе фармацевтических, пестицидных
препаратов и флотореагентов // Сб. трудов III Межд.
научно-практ. конф. "Исследование, разработка и применение высоких
технологий в промышленности" − Санкт-Петербург, 2007. − Т.
8. − С. 70-71.
3 Курманкулов Н.Б. Гетеро(N-, O-, S-)атомные пропаргильные
соединения в качестве химических средств защиты и регуляторов роста растений.
// Пищевая технология и сервис – 2008. – № 4. – С. 51-56.
4 Никольский М.А., Панкин М.И., Султанова З.К., Харламова Т.А., Сотникова
В.В., Визер С.А., Курманкулов Н.Б., Ержанов К.Б. Применение новых регуляторов
роста растений при выращивании подвоев яблони и винограда // Садоводство и
виноградарство. – 2009. - № 4. – С. 2-6.
5 Никольский
М.А., Панкин М.И., Бортникова К.А., Ермаганбетов Р.Р., Акимбаева Н.О., Ержанов
К.Б., Султанова З.К., Сотникова В.В. Результаты международного научного
сотрудничества по поиску и испытанию новых стимуляторов роста растений //
Плодоводство и виноградарство Юга России. Тематический сетевой электронный
журнал. – 2010. - № 5 (4). – 7 с. www.journal.kubansad.ru/archive/5
6 Сычева
Е.С., Асылханов Ж.С., Сактаганов А.Е., Курманкулов Н.Б., Ержанов К.Б. Синтез и химические модификации
1,5-ди(проп-2-инилокси)нафталина // Материали за VI Международна научна практична конференция
«Новини за модерна
наука – 2010». София, 17-25.2010. «Бял ГРАД-БГ» ООД – Т. 19. – С. 11-14.