Медицина / 7.
к.т.н. Родионов И.В.1,
к.т.н. Бутовский К.Г.1, д.в.н. Анников В.В.2
Саратовский государственный технический
университет1
Саратовский государственный
аграрный университет им. Н.И. Вавилова2
Влияние оксидных биопокрытий
костных имплантатов на их приживляемость и эффективность функционирования
В современной медицине широко применяются и исследуются биотехнические изделия и системы, в которых различные элементы и части взаимодействуют с биологическими жидкостями, мягкими и твердыми тканями организма. Это относится, в первую очередь, к имплантационным изделиям, предназначенным для травматологии, ортопедии и стоматологической хирургии. Материалы данных изделий должны обладать определенным комплексом биологических, физико-химических, медико-технических свойств, придающих им заданный уровень совместимости с биосредой. Исследования в области биомедицинских материалов и технологий получения костных имплантатов ведутся в нескольких основных направлениях:
- изучение процессов взаимодействия материалов имплантатов с биологическими жидкостями и тканями,
- разработка методов получения
материалов и покрытий с заданными параметрами биосовместимости,
- создание качественных и
количественных методов оценки свойств биосовместимых материалов костных
имплантатов,
- совершенствование методов
экспериментально-клинического применения ортопедических и стоматологических
имплантатов из биосовместимых материалов.
Наибольшее значение в повышении эффективности процессов диагностики, хирургического лечения, восстановления функций либо замены костных частей скелета, а также реабилитации пациентов имеет разработка методов получения материалов и покрытий имплантатов, обладающих качествами биологической и механической совместимости.
Указанная биомеханическая совместимость костных имплантатов достигается, в основном, за счет применения определенных металлических и неметаллических материалов, которые не должны вызывать иммунных реакций биосреды и организма, кроме того, их способность сохранять требуемые качества должна обеспечивать заданное функционирование имплантатов.
Биологическая совместимость имплантационных материалов обусловлена определенным уровнем их биологических и физико-химических свойств, к которым относятся токсичность, стимулирование опухолеобразования, воздействие на кровь, стерилизуемость, рентгеноконтрастность, а также электрические, магнитные, оптические, химические свойства. Механическая совместимость определяет такое поведение имплантатов под действием функциональных механических нагрузок, которое не создает в биоструктурах механических повреждений, резорбции или некроза.
Биосовместимые металлы и сплавы могут подвергаться электрохимическому
воздействию биосреды с опасностью их коррозии и появления металлоза прилегающих
тканей. Органические полимеры в этих условиях могут приобретать структурные
изменения за счет реакций водопоглощения и гидролиза с переходом продуктов
распада в окружающую биосреду. Неорганические полимеры обладают
физико-химической стойкостью, но могут иметь пониженную обрабатываемость и
недостаточный уровень механических свойств. Поэтому в зависимости от характера
биосовместимости материалов имплантатов среди них выделяют биотолерантные,
биоинертные и биоактивные (рис.).
Биотолерантные
и биоинертные материалы, окруженные биосредой, с большей или меньшей
активностью адсорбируют на своей поверхности протеины плазмы крови и волокна
фибрина, образующие затем слой фиброзной ткани соответствующей толщины. Этот
слой ограничивает плотность формирующихся структур мягких либо твердых
биотканей на поверхности материала и не обеспечивает высокой стабильности
функционирования имплантатов в организме.
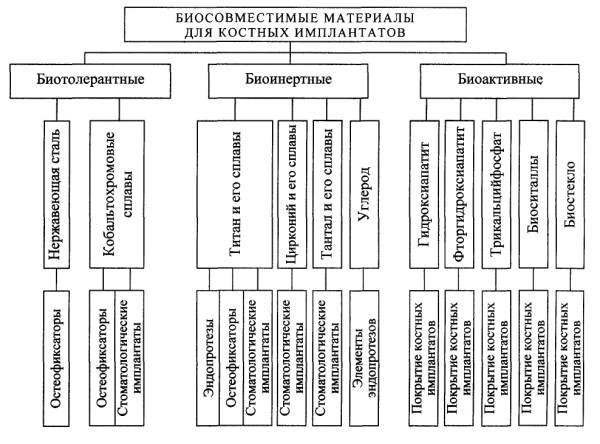
Рис. Биосовместимые материалы и покрытия,
применяемые
для изготовления костных имплантатов
Биоактивность материалов оказывает наиболее благоприятное влияние на их взаимодействие с биоструктурами. На поверхности таких материалов адсорбируется тонкий слой аморфных белковых структур, через который обеспечивается физико-химическая связь материала со средой. В этих условиях происходит ионизация атомов биоактивного материала и диффузия образовавшихся ионов в аморфный слой и биосреду. За счет протекания биоэлектрохимических реакций развивается деструкция материала, и в образующиеся несплошности происходит прорастание биоструктур окружающей среды, так что в результате формируется биотехническая система «имплантат – биосреда». Этим достигается высокая стабильность положения имплантатов и эффективность их функционирования в организме.
Особенно важное значение имеет биоактивность материалов при изготовлении и применении имплантатов значительных сроков действия, используемых в ортопедической и стоматологической хирургии. Так, приживление и функционирование костных имплантатов, а также эндопротезов в существенной степени зависит от нормального заживления имплантационной раны и протекания дальнейших процессов в зоне контакта имплантата с биосредой. Большую роль в этих условиях играют явления свертывания крови, представляющие несколько сложных стадий протеиновых реакций с коагуляцией тромбоцитов, образованием фибрина и кровяного сгустка. Данные процессы обусловливают быстрое заживление раны, но могут отрицательно сказываться на последующем функционировании имплантатов. В этих условиях на поверхности костных имплантатов может создаваться слой фиброзной ткани, ограничивающий трофику прилегающей кости и процессы остеогенеза, что препятствует образованию плотных костных структур и биоинтеграции имплантатов, стабилизирующей их положение и функционирование. В результате появляется опасность смещения имплантатов, возникновения воспалительных процессов и отторжения.
Предотвращение указанных явлений и формирование биоактивных свойств
материалов достигается за счет создания их определенного химического состава,
молекулярного строения и фазово-структурного состояния. При этом поверхностным
структурам материалов придается морфологическая гетерогенность и пористость,
что увеличивает фактическую площадь контакта материала с биосредой и усиливает
механический эффект сцепления в контактной зоне. Кроме этого, такая поверхность обладает повышенным запасом свободной
энергии и, следовательно, уровнем химической активности, что ускоряет процесс
деструкции материала и проникновения биоструктур в его несплошности.
Биоактивные материалы с приведенными поверхностными характеристиками получают при помощи довольно сложных технологических процессов, а механические свойства этих материалов оказываются на невысоком уровне, что ограничивает их применение для изготовления основ имплантатов ортопедического и стоматологического назначения, испытывающих значительные механические нагрузки. Поэтому данные материалы используются только для создания биоактивных покрытий на металлических имплантатах, имеющих биоинертные свойства (рис.).
В последние годы развиваются исследования по разработке и созданию функциональных оксидных покрытий на ортопедических и стоматологических имплантатах с целью придания им способности к интеграции с биотканями и обеспечения хорошей приживляемости [1-5]. Это связано с тем, что многие известные биокерамические материалы для покрытий являются дорогостоящими, не всегда доступны, требуют разработки специальных методов синтеза и наносятся на имплантаты с использованием сложных технологических процессов. В этом плане металлооксидные покрытия могут считаться альтернативой широко распространенным кальцийфосфатным покрытиям и характеризоваться более рациональным подходом при изготовлении костных имплантатов с биоинтеграционными качествами.
Рядом отечественных и зарубежных предприятий медико-технической направленности уже начали выпускаться имплантационные металлоизделия с оксидными биосовместимыми покрытиями, получаемыми относительно несложными, но эффективными способами оксидирования.
Оксидные
покрытия как перспективное средство повышения
качества костных имплантатов
Оксидные покрытия имплантатов, создаваемые путем электрохимического и термического видов оксидирования, защищают металлическую основу от воздействия коррозионных сред организма (кровь, лимфа, тканевая жидкость) в результате электрохимического протекторного действия, т.е. существенно понижают склонность имплантатов к коррозии. Пассивированные, коррозионностойкие имплантаты не вызывают длительных аллергических реакций организма, а также токсикологического действия на окружающие биоструктуры, что является основным показателем биосовместимости имплантационных изделий. Данные условия характеризуют инертность системы «имплантат – оксидное покрытие» к коррозионно-электрохимическому воздействию биожидкостей и во многом определяют продолжительность функционирования имплантатов.
Высокая прочность закрепления оксидированных имплантатов в кости обеспечивается за счет создания оксидных покрытий со способностью эффективного физико-механического взаимодействия с окружающей биотканью. Такая способность обусловлена наличием у покрытий поверхностной системы элементов, характеризуемой выраженной шероховатостью и морфологической гетерогенностью. Структурно-гетерогенная, пористая поверхность покрытий обеспечивает лучший контактный рост кости и более интенсивное протекание тканевых реакций в сравнении с поверхностью, имеющей гладкий, однородный микрорельеф. Поэтому развитая оксидированная поверхность способствует, во-первых, активному прорастанию костных клеточных структур в поры и углубления оксидного слоя с протеканием процесса биоинтеграции имплантата, во-вторых – направленной регенерации кости и ускоренному остеогенезу. В этих условиях происходит интенсификация деятельности биоструктур, стимулируется образование как новой костной ткани, так и новых кровеносных микрорусел, восстанавливаются нормальные биологические процессы в зоне имплантации. Вместе с тем, оксидные покрытия ортопедических и стоматологических костных систем обладают высокими показателями механических свойств, характеризующими необходимую механическую совместимость металлооксидов с тканями и действующими нагрузками.
Указанные
особенности оксидных биопокрытий позволяют имплантатам хорошо адаптироваться к
окружающим условиям организма, прочно закрепляться в кости и эффективно
выполнять заданные медицинские функции.
В современной медицине считается, что успех хирургического лечения различных костных патологий опорно-двигательного аппарата и челюстно-лицевой области с применением имплантатов во многом зависит от продолжительности процессов регенерации костной ткани. Данные процессы нередко протекают в условиях инфицирования имплантационной зоны и наличия очагов хронической инфекции, а также на фоне нарушенной микроциркуляции крови и образования кровяных сгустков. При этом в течение многих лет наиболее эффективным методом устранения подобных биологических явлений было применение местной антибиотиковой терапии и других веществ, ограничивающих деятельность патогенных микроорганизмов и нормализующих кровоснабжение в зоне имплантации. Применение имплантатов с оксидными покрытиями, модифицированными лантаном с антисептическими и антитромбогенными свойствами, может способствовать оптимизации процесса репаративного остеогенеза за счет обеспечения противовоспалительного и тромборезистентного действий, а также в виду усиления фактора роста кости (остеостимуляции) [6-8]. Это подчеркивает перспективность и инновационный подход к применению оксидных лантаносодержащих биопокрытий в костных имплантационных системах.
Перечисленные
факторы и результаты собственных исследований показывают возможность расширенного
эффективного использования имплантатов с оксидными биоинтеграционными
покрытиями в практике хирургического лечения различных костных патологий
опорно-двигательного аппарата и челюстно-лицевого отдела.
Эффективность
применения костных имплантационных систем
с оксидными биопокрытиями
Применение ортопедических и стоматологических металлоимплантатов для лечения различных костных патологий осуществляется по итогам проведения комплекса клинических испытаний, определяющего влияние биомедицинских качеств имплантатов на прилегающие биоструктуры и эффективность выполнения функций в организме. При этом ортопедические имплантаты, представляющие в большинстве случаев чрескостные спицевые и стержневые остеофиксаторы аппаратов внешней фиксации, выполняются, как правило, из нержавеющей хромоникелевой стали 12Х18Н9Т, 12Х18Н10Т и титанового сплава ВТ16, а стоматологические имплантаты изготовляются, в основном, из технического титана ВТ1-0, ВТ1-00.
Клинические испытания титановых и стальных имплантатов без покрытий и с оксидными биопокрытиями, полученными электрохимическими и газотермическими способами при установленных оптимальных условиях, проводились на основе существующих биомедицинских требований и действующих нормативов (табл. 1, 2). Путем установки опытных имплантатов в костные сегменты лабораторных животных определялось токсикологическое влияние материалов и покрытий имплантатов на организм, устанавливалась их способность к интеграции с окружающей костной тканью, выявлялись морфологические изменения структуры кости в контактной зоне. При этом основным условием нормальной приживляемости и функционирования имплантатов было наличие явления их биоинтеграции – биологически прочного соединения структуры поверхности с тканями.
Таблица 1
Способы электрохимического оксидирования костных
титановых имплантатов и функциональные характеристики анодно-оксидных
биопокрытий
|
Способ оксидирования |
Электролит, г/л |
Режим электролиза |
Характеристики покрытий |
||||||||||
|
i,
А/дм2 |
t,
0С |
τ, ч |
фазовый состав |
h,
мкм |
σадг, МПа |
Нкв, ГПа |
П, % |
Ес, В |
Шероховатость, мкм |
||||
|
Rа |
Rmax |
Sm |
|||||||||||
|
Анодирование |
(200) H2SO4 |
0,5-1 |
40-50 |
0,9 |
TiO2-х |
15-30 |
25 |
9-10 |
18-25 |
0,18 |
1,10 |
5,50 |
14 |
|
(200) H2SO4 и (50) CuSO4· 5Н2О |
1-3 |
40-50 |
0,3-0,9 |
TiO, TiO2, Ti2O3, CuO |
30-50 |
29 |
10 |
30-35 |
0,15 |
1,35 |
6,20 |
10 |
|
Примечание. Перед оксидированием
поверхность имплантатов подвергалась пескоструйной обработке корундовым
абразивом
Таблица 2
Способы высокотемпературного оксидирования костных
металлоимплантатов и функциональные характеристики термооксидных биопокрытий
|
Способ оксидирования |
Материал имплантатов |
Режим обработки |
Характеристики покрытий |
||||||||||
|
рсреды, атм |
t,
0С |
τ, ч |
фазовый состав |
h,
мкм |
σадг, МПа |
Нкв, ГПа |
П, % |
Ес, В |
Шероховатость, мкм |
||||
|
Rа |
Rmax |
Sm |
|||||||||||
|
Паротермическое |
сталь 12Х18Н9Т, 12Х18Н10Т |
1,3-1,5 |
550 |
1,5-2 |
Fe3O4, FeNi, Ti3O5 |
35-55 |
- |
5,2-5,4 |
31-34 |
-0,33 |
1,2-1,3 |
5,4-5,9 |
10-14 |
|
титан
ВТ1-0,
ВТ1-00, титановый сплав ВТ16 |
450-550 |
2-3 |
TiO2-х |
14-45 |
34-40 |
6,8-6,9 |
33-45 |
0,06-0,24 |
0,9-1,2 |
4,4-5,6 |
10-12 |
||
|
Воздушно-термическое |
сталь 12Х18Н9Т, 12Х18Н10Т |
норм. |
400-500 |
0,5 |
Fe2O3, FeNi, Ti3O5 |
25-40 |
23-26 |
4,8-5,5 |
34-39 |
-0,38 |
1,1 |
5,6-5,8 |
~8 |
|
Аргонокислородное |
титан
ВТ1-0,
ВТ1-00, титановый сплав ВТ-16 |
1,2-1,3 |
600-1000 |
2-4 |
TiO2-х |
16-40 |
- |
- |
12-42 |
0,16-0,35 |
1,1-1,3 |
4,1-6,4 |
10-15 |
Примечание. Перед
оксидированием поверхность имплантатов подвергалась пескоструйной обработке
корундовым абразивом
Результаты испытания титановых (ВТ1-00, ВТ16) и стальных (12Х18Н9Т) имплантатов без оксидных покрытий изготовленных с применением токарной обработки и последующей пескоструйной обдувки поверхности показали отсутствие токсикологического действия на биоструктуры, не выявили существенных воспалительных осложнений, не обнаружили мутагенного действия материалов имплантатов. Однако при наличии у таких имплантатов определенной биосовместимости не наблюдалось интеграционное взаимодействие их поверхности с окружающей костной тканью, не фиксировалось образование костного регенерата и не создавалось прочное закрепление в организме. По истечении 2-3 недель испытания имплантаты начинали расшатываться с проявлением признаков отторжения, что говорит об отсутствии у имплантатов без покрытия наличия каких-либо биоинтеграционных качеств.
Титановые имплантаты с анодно-оксидными и парооксидными покрытиями имели поверхностно-гетерогенную и пористую биоактивную структуру, обеспечившую их биоинтеграцию и прочное закрепление в кости. При этом после 45 суток испытания на поверхности оксидированных имплантатов и в прилегающей к ним области было выявлено присутствие новообразованной костной ткани, указывающей на протекание нормальных раневых процессов в зоне имплантации и стимулированный рост кости. Имплантаты с такими покрытиями надежно функционировали в костях лабораторных животных на протяжении всего периода испытания.
Стальные имплантаты с воздушно-оксидными и парооксидными покрытиями обладали поверхностной структурой, физико-химическими и механическими свойствами, создавшими необходимые условия для протекания их эффективной биоинтеграции без появления ярко выраженных иммунных реакций тканей. Имплантаты успешно адаптировались в организме с образованием прочной взаимосвязи с окружающей костью, характеризовались отсутствием подвижности и смещений при функционировании. После извлечения имплантатов из костей животных отмечалось наличие на оксидированной поверхности значительных фрагментов костной ткани, что свидетельствует о выраженной биоинтеграционной способности применяемых покрытий [9].
Клинические наблюдения и оценка эффективности функционирования костных имплантатов с анодно-оксидными, воздушно-оксидными и парооксидными биопокрытиями проводились в процессе реального лечения больных с переломами и деформациями костей опорно-двигательного аппарата методом наружного чрескостного остеосинтеза. Наблюдения включали определение характера биомеханического поведения и уровня прочности закрепления имплантатов в кости, оценку жесткости фиксации аппарата внешнего остеосинтеза, регистрацию послеоперационных осложнений, а также смещений костных отломков от заданного положения. При этом для лечения отбирались пациенты различных возрастных групп и весовых категорий, имеющие разные виды костной патологии.
В результате хирургического лечения было установлено, что стержневые титановые (ВТ16) и стальные (12Х18Н9Т) имплантаты-остеофиксаторы с оксидными покрытиями обеспечивают высокую жесткость фиксации аппаратов остеосинтеза на костных отломках в течение всего срока функционирования, не подвергаются расшатыванию при нагрузках на оперированный сегмент, не создают смещения отломков от заданного положения. Применяемые ортопедические металлоимплантаты не вызывали существенных послеоперационных осложнений, длительного воспаления тканей, а также признаков негативного влияния на процесс их приживления. Рентгенологические и микробиологические исследования биоструктур имплантационной зоны не выявили значимых отклонений от нормы как на начальном, так и на последующих этапах лечения.
После консолидации переломов, исправления костных деформаций и окончания лечения в целом оксидированные чрескостные имплантаты удалялись из костей с минимальной травматизацией тканей, что обусловлено врастанием костных структур на определенную глубину пор оксидных покрытий, составляющую, в среднем, 15-25 мкм.
Положительные результаты были достигнуты в 91% случаев лечения пациентов с различными переломами и деформациями костей опорно-двига-тельного аппарата, что на 10-15% выше, чем при лечении костных патологий с использованием имплантатов без биоинтеграционного покрытия.
Таким образом, эффективность применения металлоимплантатов с разработанными электрохимическими и газотермическими оксидными биопокрытиями в лечебно-медицинской практике подтверждена результатами проведенных лабораторных и клинических исследований, а оксидированные костные имплантаты зарекомендовали себя как высококачественную имплантационную систему.
Литература
1. Родионов И.В.
Анодное оксидирование в производстве имплантатов для стоматологии,
травматологии и ортопедии / Маtеriały IV Międzynarodowej naukowi-praktycznej konferencji
«Aktualne problemy nowoczesnych nauk – 2008». Przemyśl,
Polsкa:
Nauka i studia. Tym 20 (Chemia i chemiczne technologie). S. 32-36.
2. Родионов И.В. Способ получения биопокрытий на стоматологических и ортопедических костных имплантатах термооксидированием в смесях инертных и окисляющих газов / Маtеriály IV Mezinárodní
vĕdecko-praktická konference «Efektivní nástroje
moderních vĕd – 2008». Praha, Czech Republic: Publishing House
«Education and Science» s.r.o. Díl 15 (Chemie a chemická technologie).
S. 52-55.
3. Родионов
И.В., Бутовский К.Г., Ткачева А.В., Бейдик О.В. Металлооксидные биопокрытия
фиксаторов для чрескостного остеосинтеза // Инженерная физика. №4, 2007. С.
58-61.
4. Родионов И.В., Бутовский К.Г., Бейдик О.В. Сравнительная оценка параметров биосовместимости титанооксидных покрытий чрескостных фиксаторов / Сб. статей 13-й Междунар. научно-практич. конф. студентов, аспирантов и молодых ученых «Современные техника и технологии», 2007. Т.1. Томск. С. 534-537.
5. Родионов И.В., Бутовский К.Г. Получение
биосовместимых морфологически гетерогенных покрытий на стальных остеофиксаторах
воздушно-термическим оксидированием / Материалы Всероссийской
научно-практической конференции «Новые технологии создания и применения
биокерамики в восстановительной медицине». Томск: Изд-во ТПУ, 2007. С. 103-108.
6. Родионов И.В. Катодная
модификация лантаном оксидных биопокрытий медицинских имплантатов / Маtеriály IV Mezinárodní vĕdecko-praktická konference «Evropská vĕda XXI století – 2008». Praha, Czech Republic: Publishing House «Education
and Science» s.r.o. Díl 12 (Chemie a chemická technologie). S. 21-24.
7. Родионов И.В.
Катодная модификация термооксидированных чрескостных остеофиксаторов лантаном.
Особенности процесса, механизм и кинетика / Маtеriály IV Mezinárodní
vĕdecko-praktická konference
«Vĕda: teorie a praxe – 2008». Praha, Czech Republic: Publishing House
«Education and Science» s.r.o. Díl 10 (Chemie a chemická technologie).
S. 22-32.
8. Родионов И.В. Структурно-химические характеристики оксидных биопокрытий остеофиксаторов, катодно-модифицированных лантаном / Маtеriály IV Mezinárodní
vĕdecko-praktická konference «Přĕdní
vĕdecké novinky – 2008». Praha, Czech Republic: Publishing House
«Education and Science» s.r.o. Díl 4 (Chemie a chemická technologie).
S. 37-40.
9. Родионов
И.В., Бутовский К.Г., Анников В.В., Хапрова Т.С., Фролова О.Н. Биоинтеграционные
качества термооксидных покрытий чрескостных стержневых металлофиксаторов при
клинических испытаниях // Наукоемкие технологии. №8. Т.9, 2008. С.
57-66.