Технические науки/ Металлургия
К.т.н.
Дзюба О.И., Попрожук О.А. ОАО «Завод КОНСТАР»,
Селикова
М.В. , КИ
КУЭИНТУ
Исследования
процесса термообработки железосодержащих продуктов
В настоящее время в качестве исходного
сырья для производства ферритов используют прокатную окалину и порошки оксида
железа, полученные искусственным путем в результате термохимической переработки
растворов хлорида или сульфата железа, что обуславливает их высокую стоимость.
Качественное улучшение свойств ферритовых магнитов в отечественной практике
зависит в первую очередь от решения проблемы сырьевой базы - замены окалины,
которая все больше загрязняется примесями цветных металлов, на
высококачественные железные концентраты.
Железные породы Криворожского
бассейна характеризуются большой пестротой вещественного состава с присутствием
одновременно двух, трех и более железорудных минералов и сложным распределением
разновидностей. Они могут быть разделены на две большие группы: бедные руды -
железистые кварциты или железистые роговики и джеспилиты, пласты которые
совместно со сланцевыми горизонтами образуют железную свиту; богатые руды,
залежи которых находятся в породах железорудной свиты на контакте последней с
верхней сланцевой свитой или приурочены к площадной коре выветривания этой
свиты. Главные минеральные компоненты железистых роговиков и джеспилитов -
оксиды Fe и кварцит, содержащиеся примерно
в равных количествах. Сумма их обычно составляет 80-90% и более. Минералами -
примесями являются карбонаты и силикаты, большей частью железистые. Такие
минералы, как сульфиды, апатит и др., присутствуют лишь в долях процента. В
соответствии с общей слоистой текстурой этих пород отдельные минералы также
располагаются послойно. В не окисленных рудах главный минерал - магнетит. Он
находится в виде мелких кристаллических зерен, полиэдров и их агрегатов. Рудные
минералы - спутники в не окисленном виде представлены железной слюдкой или
сидеритом совместно с железистыми силикатами: биотитом, хлоритом, куммингтонитом,
гранатом, рибекитом, эгирином. Кроме мелкочешуйчатой и пластинчатой железной
слюдки нередко наблюдается примесь весьма тонкодисперсного гематита, придающего
роговиковым слоям характерную красную окраску. Из окисленных и полуокисленных
пород промышленное значение имеют мартитовые и магнетит-мартитовые руды. Ценное
свойство железистых кварцитов - отсутствие в них вредных примесей (сера,
фосфор, цинк), массовая доля которых в рудах не превышает сотых долей процента.
Железо в рудах находится в двух- и трехвалентном состоянии. Исследование химического
состава магнетита различных разновидностей железистых кварцитов обнаруживает
незначительное изоморфное замещение Fe (II) на Fe (III). Максимальная массовая доля общего железа в чистом магнетите составляет
72,36%, в чистом гематите - 70%. Двухвалентное железо входит в состав
магнетита, карбонатов железа, силикатов (хлорит, биотит, куммингтонит), пирита,
пирротина. Fe3+ входит в состав магнетита
(48,24%), гематита (70%), гидроксидов железа (50-60%), силикатов (эгирин,
родусит, зеленая слюда).
Для производства ферритов исходному
сырью предъявляется целый ряд требований. В основном железосодержащие концентраты
не удовлетворяют требованиям по содержанию SiO2 и FeО. Если SiO2 можно удалить обогащением, то все
минералы железа переводить в Fe2O3 можно
только термообработкой.
Для обоснованного
целенаправленного исследования процесса окисления Fe2+, содержащего в концентратах
представляется целесообразным предварительно оценить расчетными методами
влияния химического и минералогического составов исходного сырья, газовой фазы
и температуры на состав конечного продукта. Такая оценка может быть выполнена
путем термодинамического и кинетического анализа поведения исходных сырьевых
систем в условиях высоких температур сырья.
В качестве исходного сырья был
взят магнетитовый концентрат ЦГОКа с массовым содержание в пересчете на оксиды,
%: FeO-28,28; Fe2O3-70,85; SiO2- 0,24; Al2O3-0,2; CaO-0,08; MgO-0,2; MnO-0,003. Проба представлена в основном магнетитом, с небольшими примесями
других железосодержащих минералов. Термодинамический анализ проводили при
давлении 0,1 МПа в температурном интервале 300-2000 К. Массовая доля
подаваемого в систему O2 изменялась от 0,2 г/м3
до 0,5 г/м3.
Газовая
фаза состоит из O2, N2, H2O. В конденсированной фазе в интервале
температур 600-650 К образуются Mg2SiO4 и CaSiO3. Наряду с образованием целевого
продукта, начиная с температуры 650К, могут появляется ферриты. Согласно
полученным данным термодинамического расчета можно сделать вывод о том, что
максимальное количество целевого продукта образуется уже при температуре 900-950
К.
Так как термодинамические расчеты не всегда
согласуются с практикой, а лишь дают общую картину происходящих процессов, нами
были проведены кинетические исследования. Исследования по кинетике проводились на приборе TGA/DSC1/1600HF
фирмы. Это прибор совмещенного термограви-метрического анализа и
дифференциальной сканирующей калориметрии с высокотемпературной печью. Герметичная печь с
горизонтальным располо-жением, обеспечивала ламинарный поток газа продувки и
снижающим влияние потоков газа на измерение показаний массы. Рабочий диапазон от комнатной температуры до
1600°C. Скорости нагрева изменялись
от 10 до 40K/мин с шагом 0,16°KC/мин. Сигнал дифференциальной сканирующей
калориметрии в автоматическом режиме. Относительная погрешность измерения
теплоемкости: в интервале до 1000оС – не более 2%, свыше 1000оС
– не более 5%. Калибровка прибора проводилась по массе (внешней и встроенной гирями), по температуре, по тепловому
потоку, по времени теплопередачи τlag, обеспечивающая независимость
измерений температур исследуемых эффектов от скоростей нагрева. Результаты
исследований представлены на рис.1
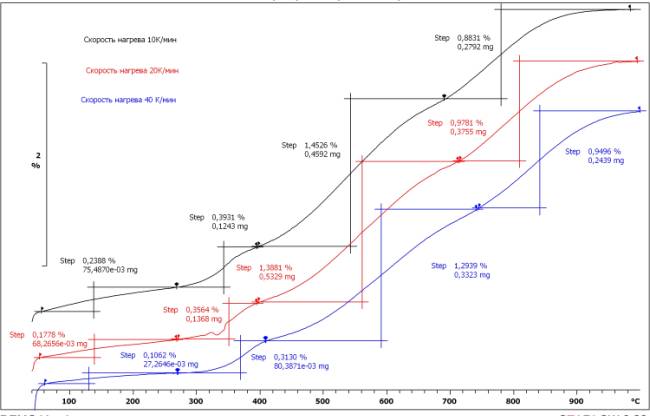
Рис.1 Результаты
термоанализа
Как
показывают результаты термического анализа, при всех скоростях нагрева образец
ведет себя одинаково. Окисление
продукта происходит в 4 стадии. Первая стадия: начало окисления 130-140оС,
окончание 270оС. Вторая
стадия: начало 280-320оС, окончание 400-410оС. Третья стадия:
начало 550-600оС, окончание 700-760оС. Четвертая стадия:
начало 800-840оС, окончание 1000оС.
Таким образом, в результате проведенных
исследований показана принципиальная возможность перевода всех двухвалентных
соединений Fe в трехвалентные. Проведенные исследования следует продолжить в
направлении моделирования процесса кинетики с выбором кинетических уравнений
наиболее адекватно описывающий процесс термообработки. Это позволит сократить
время проведения исследований при колебаниях вещественного состава железосодержащих
концентратов и правильно подбирать необходимое термическое оборудование при
проектировании новых установок.