Бойчук С.В.,
Дунаев П.Д., Мустафин И.Г.
Казанский
государственный медицинский университет, Россия
Продуктивно
инфицированные ВИЧ-1 и неинфицированные CD4+-лимфоциты обладают
различной чувствительностью к апоптозу
Актуальность.
Механизмы
апоптоза различных популяций CD4+-Лф
(продуктивно инфицированных ВИЧ-1 и неинфицированных) до сих пор остаются до
конца не выясненными. С одной стороны, логичными выглядят результаты
исследований, иллюстрирующие ослабление программы апоптоза в инфицированных
ВИЧ-1 CD4+-Лф и клеточных линиях, что в свою очередь, является
необходимым фактором, обеспечивающим создание предпосылок для репликации вируса
и резервуаров ВИЧ-1 [2, 3, 9]. С другой стороны, имеются многочисленные данные
об усилении гибели CD4+-Лф и клеточных линий, инфицированных
ВИЧ-1 [5, 6, 7]. Данное противоречие может быть лишь отчасти объяснено
различиями лабораторных штаммов, использованных для инфицирования Лф in vitro [8]. В то же время, анализ активности различных
структурных, регуляторных и вспомогательных белков ВИЧ-1 доказывает
правомочность существования двух противоположных точек зрения.
В связи с
изложенным выше, представляло интерес комплексное изучение восприимчивости к
апоптозу CD4+-Лф, продуцирующих ВИЧ-1 (далее
именуемых как клетки-продуценты ВИЧ-1) и неинфицированных CD4+-Лф.
Материалы и методы исследования.
Лф периферической крови доноров,
серонегативных по ВИЧ-1, выделяли на градиенте плотности раствора Фиколл-Пак и
подвергали предварительной активации в течение 48-72 ч с помощью фитогемагглютинина
(ФГА) в концентрации 2 мкг/мл или в присутствии интерлейкина-7 (ИЛ-7). Далее в
культуру преактивированных Лф вносили эквивалентные дозы ВИЧ-1 (MOI = 0,005). В контрольной серии экспериментов использовали
неактивированные Лф. Количество клеток-продуцентов ВИЧ-1 определяли методом
проточной цитометрии по внутриклеточному содержанию в них сердцевинного
вирусного белка р24gag. С
этой целью клетки преинкубировали с моноклональными антителами (мкАТ) к р24gag («Coulter»). Аналогичная методика инфицирования и подсчета
количества инфицированных клеток была использована при внесении ВИЧ-1 в
культуру клеточной линии CEMx174. Подсчет
количества продуктивно инфицированных клеток в линии CEM-GFP был основан на изменении интенсивности флуоресценции GFP, также определяемой методом проточной цитометрии.
В качестве источника ВИЧ-1 использовали штамм
NL4-3 (NIH AIDS Research & Reference Reagents Program, США) [2].
Титры ВИЧ-1 определяли традиционным методом лимитирующих разведений по Reed-Muench, инфекционную
способность ВИЧ-1 оценивали с использованием индикаторных линий HeLa-CD4-βgal и MAGI-CCR5 (NIH AIDS Research & Reference Reagents Program, США). Для инфицирования было выбрано несколько
экспериментальных моделей: 1) культура Лф, предварительно активированных ФГА;
2) клеточные линии CEMx174 и CEM-GFP; 3) Лф,
активированные ИЛ-7.
Во всех случаях репликацию ВИЧ-1 оценивали
по содержанию р24gag-антигена
ВИЧ-1 в супернатантах клеточных культур (EIA p24gag, «Coulter»).
Оценку апоптоза Лф осуществляли методом
проточной цитометрии по следующим параметрам: снижению величины трансмембранного
митохондриального потенциала (ΔΨm), экспрессии молекул
фосфатидилсерина (ФС) и фрагментации ДНК. Для этого использовали
соответствующии флуорохромы и реагенты: 1) ΔΨm – флуорохромы CMX-Ros («Molecular Probes») и DiOC6 («Sigma»); 2) ФС – флуорохром MC 540 («Sigma»)
и Annexin V-FITC («PharMingen»); 3) фрагментация ДНК –
флуорохромы пропидиума йодид (PI) и 7-амино-актиномицин (7-ADD) («Sigma»).
Для оценки апоптоза продуктивно инфицированных и неинфицированных клеточных
популяций проводили многоцветовое окрашивание с использованием указанных выше
флуорохромов и мкАТ к р24gag-антигену ВИЧ-1 («Coulter»),
состоящее из этапа окрашивания клеток на ФС с Annexin V-FITC, с
последующими отмывкой, пермабилизацией и внутриклеточным окрашиванием на р24gag-антиген
мкАТ, меченными РЕ («Сoulter»). Пермабилизацию клеток
проводили с помощью BD FACS permabilizing solution 2 («Becton Dickinson»), согласно методике производителей.
Определение
активационного статуса продуктивно инфицированных и неинфицированных Лф
проводили с помощью поверхностного окрашивания Лф на CD25-антиген мкАТ, меченными FITC, и
внутриклеточного выявления р24gag-антигена мкАТ, меченными
РЕ. Внутриклеточное окрашивание р24gag-антигена проводили после
поверхностного окрашивания на CD25-антиген, пермабилизации
Лф с помощью BD FACS permabilizing solution 2 («Becton Dickinson»).
Результаты.
Внесение ВИЧ-1 в культуру покоящихся Лф
(т.е. предварительно неактивированных с помощью ФГА) не приводило к вирусной
репликации, в то время как инфицирование вирусом ФГА-преактивированных Лф
инициировало данный процесс. Пик вирусной репликаци в культуре
ФГА-активированных Лф наблюдался на 4-5-е сутки после внесения вируса в культру
Лф.
Внесение ВИЧ-1 в культуры CEMx174 и CEM-GFP инициировало репликацию ВИЧ-1, пик которой наблюдался
на 4-е и 6-е сутки культивирования соответственно. Преинкубация покоящихся
(т.е. не экспрессирующих маркеры активации) Лф с ИЛ-7 и последующее внесение
ВИЧ-1 в культуру Лф инициировали в них вирусную репликацию, пик которой
регистрировался на 7-е сутки культивирования. Следует подчеркнуть, что уровень
репликации ВИЧ-1 во всех экспериментальных моделях коррелировал с количеством
продуктивно инфицированных клеток.
Изучение уровня апоптоза среди продуктивно
инфицированных и неинфицированных клеток выявило следующие закономерности. В
культуре ФГА-активированных Лф количество апоптозных клеток среди продуктивно
инфицированных и неинфицированных Лф существенно не различалось. Отсутствие различий
было подтверждено при оценке всех использованных в настоящим исследовании
маркеров апоптоза: снижения величины ΔΨm, появления молекул ФС на
клеточной поверхности и фрагментации ДНК.
Изучение
динамики событий, происходящих в CD4+-Лф, гибнущих
по механизму апоптоза, показало, что снижение величины ΔΨm
является самым ранним признаком их программированной гибели. За этим следовало
повышение уровня экспрессии молекул ФС, регистрировавшееся исключительно на
популяции клеток со сниженной величиной ΔΨm (рис. 1).
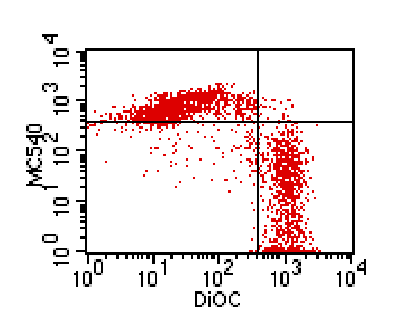
Рис. 1. Экспрессия ФС на
поверхности CD4+-Лф, определяемая по интенсивности
флуоресценции МС 540, и величина ΔΨm, определяемая по интенсивности флуоресценции DiOC6.
Конечным признаком
апоптоза CD4+-Лф являлась фрагментация их ДНК. Подобная
закономерность прослеживалась как на неинфицированной популяции клеток, так и
на популяции клеток, являвшихся продуцентами ВИЧ-1. Дискриминация данных популяций основывалась на
внутриклеточном определении уровня р24gag-антигена
ВИЧ-1.
Следует подчеркнуть, что подавляющее количество
клеток, являющихся продуцентами ВИЧ-1, в культуре ФГА-активированных Лф было
представлено пролиферирующими клетками. Исследование экспрессии активационных
маркеров в культуре ФГА-активированных Лф показало, что пул клеток-продуцентов
ВИЧ-1 был представлен преимущественно активированной популяцией клеток,
экспрессирующей различные маркеры активации (например, CD25) (рис. 2). Аналогичная закономерность была
выявлена и при исследовании других активационных маркеров (CD69, CD71, HLA-DR).
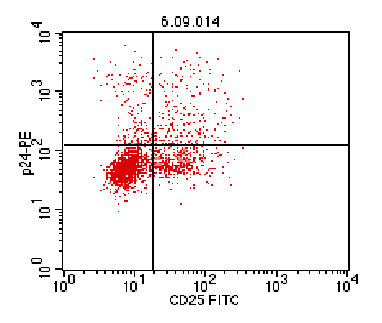
Рис. 2. Экспрессия CD25 на поверхности продуктивно инфицированных (р24gag-позитивных) и неинфицированных (р24gag-негативных) Лф в культуре ФГА-активированных Лф (По
оси абсцисс – интенсивность флуоресценции мкАТ к CD25, меченных FITC; по оси ординат – интенсивность флуоресценции мкАТ
к р24gag, меченных с РЕ).
Аналогичная закономерность,
иллюстрирующая одинаковую подверженность гибели по механизму апоптоза, была
выявлена при подсчете количеств апоптозных клеток среди инфицированных и
неинфицированных клеток линий CEMx174 и CEM-GFP.
Данная закономерность была наиболее выраженной на пике вирусной репликации,
оцениваемой по количеству сердцевинного вирусного белка р24gag в супернатантах клеточных культур.
В то
же время, при внесении ВИЧ-1 в культуру ИЛ-7-активированных Лф наблюдались
существенные отличия от выявленной ранее закономерности. Было установлено, что
преактивация Лф данным цитокином способствует развитию резистентности к
апоптозу у продуктивно инфицированных клеток (по сравнению с неинфицированной
популяцией Лф) (рис. 3).
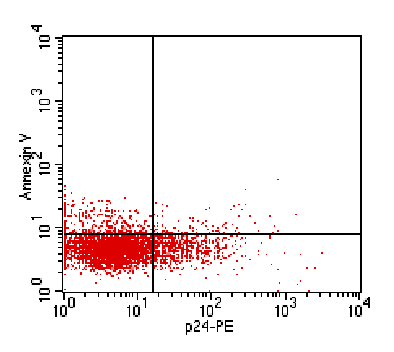
Рис. 3. Апоптоз Лф,
оцениваемый по экспрессии ФС (Annexin V-FITC – верхние квадраты в режиме dot-plot), у продуктивно
инфицированных Лф (р24gag-позитивных: правые квадраты в режиме dot-plot)
и неинфицированных Лф (р24gag-негативных: левые квадраты в режиме dot-plot).
Кроме того, продуктивно
инфицированные Лф, культивированные в присутствии ИЛ-7, были представлены
гетерогенным пулом клеток. В отличие от всех использованных нами экспериментальных
моделей, в культуре ИЛ-7-активированных Лф пул клеток-продуцентов ВИЧ-1 был
представлен в основном минимально активированными и непролифирирующими
клетками.
Заключение.
Результаты изучения
механизмов апоптоза продуктивно инфицированных и неинфицированных клеток с
использованием различных моделей подтверждают противоречивость ранее полученных
и опубликованных данных исследований, посвященных сравнительному анализу
восприимчивости к апоптозу у инфицированных и неинфицированных популяций CD4+-Лф.
Важно отметить, что
результаты исследований, получаемые с использованием модели ФГА-активированных
Лф, а также клеточных линий, не являются точным прототипом механизмов вирусной
репликации, происходящей in vivo. Действительно, уровень
активации и пролиферации в культуре ФГА-активированных клеток чрезвычайно
высок, а клеточные линии имеют изначально высокий пролиферативный потенциал
(один из необходимых критериев, предъявляемых к клеточным линиям). В то же
время, количество пролиферирующих клеток in vivo,
а также уровень экспрессии на их поверхности активационных маркеров (особенно у
продуктивно инфицированных Лф) существенно ниже.
В то же время,
использованная нами модель активации Лф с помощью ИЛ-7 наиболее реально
отражает ситуацию in vivo, при которой подавляющее
число CD4+-Лф, способных быть инфицированными ВИЧ-1,
представлено пулом неактивированных клеток. Данные литературы, иллюстрирующие
способность ИЛ-7 индуцировать репликацию ВИЧ-1 в Лф, а также статус продуктивно
инфицированных Лф являются до настоящего времени предметом дискуссий [4, 10,
11, 12].
Выявленный феномен
репликации ВИЧ-1 в покоящихся CD4+-Лф под
влиянием ИЛ-7 и развития их последующей резистентности к апоптозу открывает
несколько новых механизмов патогенеза ВИЧ-инфекции, пернципиально отличающихся
от существовавших ранее. Во-первых, отсутствие признаков активации и
пролиферации указывает на возможность существования принципиально новых
механизмов репликации ВИЧ-1 в Лф под действием ИЛ-7. Во вторых, ИЛ-7 может
вызывать минимальную активацию Лф, не сопровождающуюся появлением ее
классических признаков, но, в то же время, достаточную для репликации ВИЧ-1.
Аналогичная возможность индукции репликации ВИЧ-1 в Лф без существенных
изменений их активационного и пролиферативного статуса была ранее нами показана
на модели культивирования Лф с эндотелиальными клетками (ЭК), являющимися, как
известно, полупрофессиональными антиген-презентирующими клетками [1]. Слабый
активационный сигнал вследствие отсутствия экспрессии ко-стимулирующих молекул
на поверхности ЭК, тем не менее, являлся достаточным для инициирования
процессов вирусной репликации в инфицированных клетках. В-третьих,
чувствительность Лф к апоптозу может быть обусловлена именно особенностями их
активационного статуса (т.к. известно, что активированные клетки являются более
чувствительными к гибели по механизму апоптоза по сравнению с
неактивированными).
Работа
частично финансировалась грантом Российского фонда фундаментальных исследований
и Правительства Республики Татарстан, проект № 13-04-97034.
Литература:
1. Бойчук С.В., Мустафин И.Г. Роль эндотелиальных клеток и ВИЧ-1 белка Nef
в патогенезе ВИЧ-инфекции: новые механизмы репликации ВИЧ-1 // Медицинская
иммунология. – 2004. – №6. – С. 499-506.
2. Бойчук
С.В., Дунаев П.Д., Мустафин И.Г. Цитокины способны регулировать процессы
репликации ВИЧ-1 и апоптоза лимфоцитов invitro // Казанский медицинский журнал. – 2013. – №6. – С. 906-910.
3. Дунаев П.Д., Иванкова
А.В., Бойчук С.В., Мустафин И.Г. Исследование роли цитокинов в патогенезе
ВИЧ-инфекции // ВИЧ-инфекция и иммуносупрессии. – 2010. – Т.2, №3. – С. 55-57.
4. Bahbouhi B., Landay A.,
Al-Harthi L. Dynamics of cytokine expression in HIV
productively infected primary CD4+ T cells // Blood. – 2004. – Vol. 103.
– № 12. – P. 4581-4587.
5. Jaleco S., Kinet S.,
Hassan J. et al. IL-7 and CD4+ T-cell
proliferation // Blood. – 2002. – Vol. 100. – № 13. – P.
4676-4677.
6.Mbita Z., Hull R., Dlamini Z. Human immunodeficiency virus-1 (HIV-1)-mediated apoptosis:
new therapeutic targets // Viruses. – 2014. – Vol. 6. – № 8. – Р. 3181-3227.
7. Pett S.L., Kelleher
A.D. Cytokine therapies in HIV-1
infection: present and future // Expert rev. antiinfect.
ther. – 2003. – Vol. 1. – № 1. – Р.
83-96.
8. Scripture-Adams D.D., Brooks D.G., Korin Y.D., Zack
J.A. Interleukin-7 induces expression of latent
human immunodeficiency virus type 1 with minimal effects on T-cell phenotype // J. Virol. – 2002. – Vol. 76. – № 24. – Р.
13077-13082.
9. Shedlock D.J., Hwang D., Choo A.Y. et al. HIV-1
viral genes and mitochondrial apoptosis // Apoptosis. – 2008. – Vol. 13, № 9. – P. 1088-1099.
10. Steffens C.M., Managlia E., Landay A., Al-Harthi
L. Interleukin-7-treated naive T cells can be
productively infected by T-cell-adapted and primary isolates of human
immunodeficiency virus 1 // Blood. – 2001. – Vol. 99.
– №9. – Р. 3310-3318.
11. Unutmaz D., KewalRamani V.N., Marmon S., Littman
D.R. Cytokine signals are sufficient for HIV-1 infection of resting human T
lymphocytes // J. Exp. Med. – 1999. – Vol.
189. – № 11. – P.
1735- 1746.
12. Vandergeeten
C., Fromentin R., Chomont. N. The role of cytokines in the establishment,
persistence and eradication of the HIV reservoir // Cytokine & Growth
Factor Reviews. – 2012. – Vol. 23, № 4-5. – P. 143-149.