Биологические
науки/10. Генетика и цитология
Министерство
лесного хозяйства Республики Татарстан, Россия
Результаты генетического анализа осины
Осина – самая неблагополучная по своему
санитарному состоянию и товарности древесная порода в лесах Республики
Татарстан, требующая к себе по добротности древостоев первоочередного внимания
лесоводов-селекционеров. Это с одной стороны полезнейшее дерево, если оно
здоровое, с другой – сорняк, понижающий экономический и экологический потенциал
лесов республики.
В Среднем Поволжье встречаются
следующие формы осины по строению и цвету коры: зеленокорая в основном с
гладкой корой и низким расположением пробковой части; серокорая
среднетрещиноватая с хорошо выраженной трещиноватостью, протяженностью от
основания ствола 2-2,5 м; серокорая мелкотрещиноватая с мелкими бороздчатыми
трещинами, протяженность трещиноватости – до двух метров; темнокорая
среднетрещиноватая с глубокими трещинами, протяженность трещиноватости до 3-4
метров от основания ствола.
В целях выявления высокопродуктивных, устойчивых
к грибным болезням клонов осины, анализа формового разнообразия осины,
произрастающей в лесах Закаья республики в 2007-2012 годах проведено полевое
обследование осинников.
Нами во время
закладки постоянных пробных площадей выявлены и поставлены на учет здоровые,
высокопродуктивные клоны. Летом 2010 года в ходе экспедиции в Нурлатское и
Билярское лесничества РТ, произведен отбор проб листьев для последующего
проведения молекулярно-биологического анализа статуса плоидности в Институте
леса Национальной академии наук Беларуси. Практическим аспектом, связанным с
фактором плоидности породы, является выявление и анализ плюсовых триплоидных
форм (в том числе гибридов) осины, а также диагностика геномных мутаций в ходе
размножения ценных генотипов в условиях in vitro.
Материал для анализа.
Экспериментальный материал для проведения
генетического анализа осины был представлен фрагментами древесины и листьев
деревьев из образцов, взятых нами на пробных площадях. Образцы были
зафиксированы в 70 % этиловом спирте.
Результаты анализа приведены согласно отчета о выполнении НИР «Генетический
анализ ценных генотипов осины на предмет определения статуса плоидности» по
договору с Министерством лесного хозяйства Республики Татарстан.
ДНК- анализ.
Выделение суммарной ДНК
проводилось СТАВ -методом.
Пробоподготовка. Образцы
древесины или листовых пластинок помещали в сепарационные колонки (размер пор
фильтра 0,5 мм) и центрифугировали при 5000 х g (T=18-20
°C) в течение 10 мин. Для удаления фиксирующей жидкости. Далее образцы
высушивали при T=45°C до полного испарения спирта.
Гомогенизация и
экстракция. Высушенный биологический материал массой 20 мкг помещали в центрифужную пробирку типа «Eppendorf»
объемом 1,5 мл. содержащую 500 мкл экстрагирующего буфера (T=65
°C), следующего состава: 2 % р-р бромида цетилтриметиламмония (СТАВ); 0,1 М р-р
трис- HCl (pH 8,0) 1,4 М р-р хлорида
натрия; 20 мМ р-р трилона Б и гомогенизировали до однородного состояния. Далее,
пробирку закрывали и перемешивали содержимое на вихревом смесителе (400 - 600
мин-1) в течение 5 с. После этого пробирки помещали на водяную баню
и инкубировали в течение 20 – 60 мин. при
65 °C.
Очистка гомогенатов. После экстракции
пробирку охлаждали до комнатной температуры, и к образцу добавляли 500 мкл
смеси хлороформа и изоамилового спирта (24:1). Содержимое перемешивали на
встряхивающей ванне (200 мин-1) в течение 20 мин. при комнатной
температуре. Далее производили центрифугирование при 5000хg (T=18-20 °C) в течение 10 мин. После этого пипеткой
отбирали 500 мкл супернатанта, переносили
в другую центрифужную пробирку типа «Eppendorf» объемом 1,5 мл. и
добавляли к нему 100 мкл буфера 5хСТАВ (5 % р-р СТАВ; 350 мМ р-р трилона Б).
Содержимое перемешивали на вихревом смесителе (400 мин-1) и
инкубировали на водяной бане в течение 10 мин. при 65 °C. После инкубации
добавляли 500 мкл смеси хлороформа и изоамилового спирта (24:1). Содержимое
перемешивали на встряхивающей ванне (200 мин -1) в течение 10 мин.
при комнатной температуре, после чего центрифугировали при 5000хg
(Т=18-20°C) в течение 10 мин. (если
раствор оставался мутным или была большая интерфаза, то процедуру очистки
хлороформом и изоамиловым спиртом повторяли).
Осаждение ДНК. По окончании чего центрифугирования пипеткой отбирали 300 мкл
супернатанта и переносили в другую центрифужную пробирку типа «Eppendorf»
объемом 1,5 мл., после чего добавляли 300 мкл буфера для осаждения, состоящего
из 1 % р-ра СТАВ; 50мМ р-ра трис- HCl (pH
8,0); 10мМ р-ра трилона Б. Содержимое перемешивали на вихревом смесителе (400
мин-1) и оставляли на 60 мин при комнатной температуре. Далее
производили центрифугирование при 8000хg (T=18-20 °C) в течение 20 мин.
Очистка препарата ДНК. Супернатант сливали, а полученный
осадок ДНК растворяли в 400 мкл буфера следующего состава: 1М р-р хлорида
натрия; 10мМ р-р трис- HCl (pH
8,0); 10мМ р-ра трилона Б. Далее добавляли 500 мкл охлажденного изопропанола и
оставляли на 30 мин. После промывки содержимое пробирки центрифугировали при 8000хg (T=4°C) в течение 10 мин. Супернатант сливали, а
полученный осадок ДНК растворяли в 200 мкл дистиллированной воды, затем к
раствору приливали 100 мкл 7,5 М ацетата аммония (pH 7,5). Пробирки
инкубировали на ледяной бане (T=0°C) в течение 20 мин., после чего
центрифугировали при 13000хg (T=4°C) в течение 10 мин. Далее к отобранному
супернатанту добавляли 300 мкл
охлажденного изопропанола и оставляли на 20 мин., после чего центрифугировали
при 13000хg (T=4°C) в течение 10 мин. Полученный осадок ДНК
промывали 500 мкл 65 % этанола,
охлажденного до температуры – 20 °C. После промывания содержимое пробирки
центрифугировали при 15000хg (T=4°C) в течение 10 мин.
Лиофилизация
препарата ДНК. После промывки этанолом
пробирки размещали в штативе и, открыв крышки, просушивали осадок ДНК в течение 30-40 мин. (T=45°C) до полного испарения этанола.
Растворение препарата
ДНК. Высушенный осадок растворяли в 100 мкл бидистиллированный и
деионизированной воды во встряхивающей
ванне (200 мин -1) при 40°C в течение 30 мин. Растворенную ДНК хранили при -20 °C
для последующего анализа.
Проведение ПЦР.
Полимеразную цепную
реакцию (ПЦР) проводили в специальных полипропиленовых пробирках объемом 0,2 мл. В ходе исследований был использован
следующий состав реакционной смеси: 10хПЦР буфер (100мМ
Трис HCl, pH 9,2, 250 мM
KCl) – 2,5 мкл, 25 мM
MgCl2 – 2,5 мкл, вода (ПЦР-реагент) – 16 мкл, смесь 5
мМ нуклеотидтрифосфатов – 1 мкл, 10мМ раствор праймера – 1 мкл, образец ДНК (40
нг/мкл) – 1 мкл, ДНК- полимераза (1 ед./мкл) – 1 мкл. В ходе исследования была
использования ПЦР- смесь на основе Taq/Pfu – ДНК полимераз (Fermentas, Литва),
составленная согласно инструкции фирмы- изготовителя.
В качестве маркеров были
использованы полиморфные SSR-локусы осины – PTR5,
PTR6, PTR8, PTR12
[4].
Структура использованных
SSR- праймеров проведена ниже:
PTR5(F-CTTCTCGAGTATAAATATAAAACACCA,R-TCACATCACCCTCTCAGTTTCGC);
PTR6
(F-AGAAAAGCAGATIGAGAAAAGAC, R-CTAGTATAGAGAAAGAAGCAGAAA);
PTR8
(F-TAGGCTAGCAGCTACTACAGTAACA, R-TTAAGTGCGCGTATCCCAAAGA);
PTR12(F-AATAACCATCCCTCCAATAACCTAC,R-TATTTTGCACCTAAATGGCTGTTCT
F-
праймер для каждого из локусов 5’-конце был мечен красителем Fam.
Амплификацию проводили
по следующей программе: 1 этап (1цикл). Денатурация. t =3 мин, Т= 94°C. 2 этап
(22 цикла). Денатурация.
t =45 сек, Т= 94°C.
Отжиг. t =25 сек, Т= 60°C. Элонгация. t =1 мин, Т= 72°C.
3 этап (1 цикл).
Элонгация. t =7 мин, Т= 72°C. 4 этап (1 цикл). Охлаждение реакционной
смеси t =5 мин, Т= 4°C.
Количество циклов
амплификации составляло 22, что связано с анализом ПЦР - продуктов на
экспоненциальной фазе ПЦР. Данная фаза характеризуется наиболее достоверными
количественными характеристиками амлифицируемых продуктов.
Проведение электрофореза
с низким уровнем разрешения.
Предварительное
электрофоретическое разделение продуктов полимеразной цепной реакции проводили
в агарозном геле. Агарозный гель (1,4 %) приготавливался путем растворения 1,4
г агарозы (2000 - 3000 мономеров) в 98,6 г 1,5 х Трис- ЭДТА –боратного буфера.
Гель помещался в электрофоретическую камеру типа «Submarine» (фирма «Helicon»).
В этом типе камер катодный и анодный
отсеки заполняются 1,5 х Трис- ЭДТА
–боратным буфером, таким образом, чтобы гель был погружен в буфер на 5 мм.
Загрузочный раствор каждой дорожки состоял из 5 мкл продуктов ПЦР и 1 мкл загрузочного буфера (30 % глицерин, 0,5 %
бромфеноловый синий). Электрофорез проводили при комнатной температуре в
течение 2 ч. При следующих параметрах тока 90 V/60 мА.
Визуализация продуктов
электрофореза достигалась окрашиванием гелевых пластин в растворе бромистого
этидия. Для этого гелевая пластина помещалась в раствор бромистого этидия (0,5
мкг/мл) и выдерживалась в красителе в течение 15 мин. Затем гель извлекался и
промывался в дистиллированной воде для удаления остатков красителя. Для
визуального наблюдения гель помещался в УФ-трансиллюминатор.
Фотодокументирование продуктов электрофореза достигалось за счет
видеосканирования в УФ – свете системой Image Master
(фирма «Amersham Pharmacia Biotech»).
Электрофоретический
анализ ампликонов SSR- локусов с помощью генетического
анализатора.
После проведения ПЦР
проводили очистку продуктов от низкомолекулярных солей, непрореагировавших
деооксинуклеотид-трифосфатов, праймеров.
Очистка меченых
продуктов. В центрифужную пробирку типа «Eppendorf» объемом 1,5 мл,
помещали 20 мкл меченых продуктов ПЦР и добавляли 40 мкл этилового спирта.
Содержимое перемешивали на вихревом смесителе (400 мин-1) и
оставляли на 1 ч. В морозильной камере (Т= -18°C). Далее производили
центрифугирование при 13000хg (T=4°C) в течение 20 мин. Полученный осадок ДНК меченых продуктов перемывали 500
мкл 95 % этанола, охлажденного до температуры – 20 °C для полного удаления
несвязавшихся продуктов.
Лиофилизация меченых
продуктов. После промывки этанолом пробирки размещали в штативе и, открыв
крышки, просушивали осадок ДНК меченых продуктов в термостате в течение 50 мин.
(Т= 45°C) до полного испарения этанола.
Растворение ампликонов.
Высушенный осадок растворяли в 10 мкл деионизированного формамида на вортексе
(200 мин-1) в течение 3 мин.
Подготовка образцов.
Растворенные меченые ампликоны разбавляли в формамиде в соотношении 1:1000,
отбирали 19 мкл и смешивали с 1 мкл маркера молекулярного веса GS500Liz
(Applied Biosystems) и денатурировали на
водяной бане (Т= 95°C) в течение 5 мин. Затем образцы резко охлаждали на льду и
хранили при – 20 °C для последующего электрофоретического фракционирования.
Электрофоретический
анализ и детекцию меченых продуктов
проводили в генетическом анализаторе ABI Prism
310 Genetic Analyzer (Applied
Biosystems) в соответствии с прилагаемой инструкцией.
Количество внесенного образца составляло 20 мкл. Для исследования был
использован 4 % денатурирующий гель РОР-4ТМ. В ходе анализа был
выбран модуль анализа GS POP4
(1ml) G5 для 36 см (50 мкм)
капилляра.
Анализ полученных
результатов проводился на основании использования программного пакета GeneMapper
4,0 (Applied Biosystems).
Интерпретация
результатов.
Выбор набора локусов для
анализа плоидности был основан на предварительном анализе эффективности
амплификации аллельных вариантов различных SSR-маркеров осины.
Использованный набор микросателлитных локусов характеризуется аллельными
вариантами с диапазоном эффективности амплификации 1,82-1,87.
Типирование плоидности
образцов на основании анализа микросателлитных спектров производилось по
следующей схеме:
Диплоидные ткани. Спектр
диплоидных образцов представлен одним или двумя пиками. В случае наличия одного
пика проведение анализа плоидности не предоставляется возможным, а его генотип
обозначается как гомозиготный по данному локусу. Типичный спектр гомозиготного
образца представлен на рисунке 1.
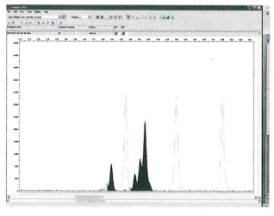
Рисунок 1 - Микросателлитный спектр диплоидной ткани
(осина, генотип PTR5258/258)
В случае гетерозиготных
образцов оба пика имеют сравнительно одинаковую величину. Образец гетерозиготных образцов диплоидной ткани
показан на рисунке 2. Разница в интенсивности сигнала аллелей для разных
образцов и вариантов опыта не должна превышать 12 %, что является статистически
допустимой погрешностью метода оценки.
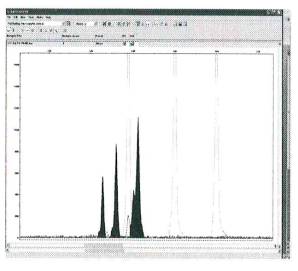
Рисунок 2 - Микросателлитный спектр диплоидной ткани
(осина, генотип PTR5249/258)
Триплоидные ткани. В случае триплоидных
тканей образцы могут быть представлены следующими вариантами генотипов: А1А1А1
, А1А1А2, А1А2А3.
В гомозиготном состоянии, как и в случае с диплоидными тканями, поведение
анализа плоидности не представляется возможным. Спектры генотипов с тремя
различающимися аллельными вариантами представлены тремя относительно равными по
высоте пиками. Спектр образцов с
генотипом А1А1А2 представлен двумя пиками,
величина одного из них превышает альтернативный, в среднем, по разным образцам
в два раза, что соответствует дозе каждого аллельного варианта.
Микросателлитный спектр генотипа А1А1А2
представлен на рисунке 3.
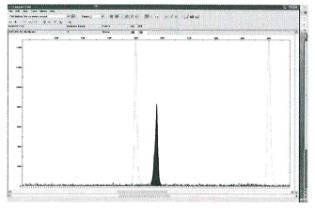
Рисунок 3 - Микросателлитный спектр триплоидной ткани
(осина, генотип PTR8136/141/141)
Микросателлитный спектр
генотипа А1А2А3
представлен на рисунке 4
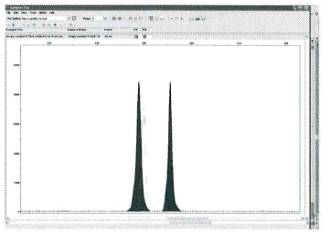
Рисунок 4 - Микросателлитный спектр триплоидной ткани
(осина, генотип PTR8133/136/141)
Миксоплоидные образцы.
Соотношение пиков аллельных вариантов статистически достоверно отличается от
соотношения 1:1 (более 12%), но не превышает разницу в 1,8 раза между аллелями.
Уровень миксоплоидии по разным локусам одного и того же образцам может быть
сходным, что указывает на отсутствие определенной селективности в отношении
какой-либо хромосомы, или различным, что указывает на избирательный характер
аномалий, рисунок 5.
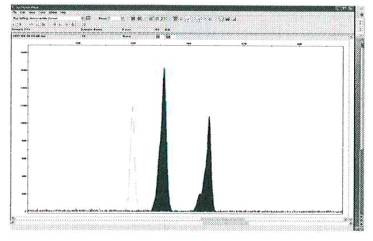
Рисунок 5 - Микросателлитный спектр миксоплоидной ткани
(осина, генотип PTR5-256/264 , уровень миксоплоидии 14%).
Результаты
На начальном этапе
исследований была проведена оценка воспроизводимости количественной оценки
уровня амплификации аллельных вариантов образцов. Для этого были выбраны два
образца осины ПП-3 №6 и ПП-4 №6. Данные образцы были пятикратно
проанализированы по набору микросателлитных локусов. Полученные результаты
анализа маркерных продуктов амплификации представлены в таблице 1.
Таблица 1
Оценка воспроизводимости уровня
амплификации маркерных ПЦР- продуктов образцов ПП-3 №6 и ПП-4 №6.
|
ПП – 3 №6 |
||||||||||
|
Номер повторности |
PTR5
1 |
PTR5
2 |
PTR6
1 |
PTR6
2 |
PTR8
1 |
PTR8
2 |
PTR12
1 |
PTR12
2 |
PTR12
3 |
Фон |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
1 |
1569 |
1764 |
1995 |
1958 |
1661 |
1301 |
1340 |
1695 |
1846 |
1012 |
|
2 |
1610 |
1793 |
2045 |
1922 |
1725 |
1317 |
1383 |
1712 |
1888 |
990 |
|
3 |
1753 |
1946 |
2387 |
2104 |
1777 |
1379 |
1465 |
1764 |
1974 |
952 |
|
4 |
1563 |
1748 |
2031 |
1893 |
1666 |
1296 |
1368 |
1620 |
1861 |
978 |
|
5 |
1851 |
2007 |
2612 |
2312 |
1975 |
1443 |
1554 |
1888 |
2217 |
1059 |
|
Относительная оценка
величины пиков |
|
|||||||||
|
1 |
1,0 |
1,350 |
1,765 |
1,698 |
1,165 |
0,519 |
0,589 |
1,226 |
1,497 |
|
|
2 |
1,0 |
1,295 |
1,702 |
1,503 |
1,185 |
0,527 |
0,634 |
1,165 |
1,448 |
|
|
3 |
1,0 |
1,241 |
1,792 |
1,438 |
1,030 |
0,533 |
0,640 |
1,014 |
1,276 |
|
|
4 |
1,0 |
1,316 |
1,800 |
1,564 |
1,176 |
0,544 |
0,667 |
1,097 |
1,509 |
|
|
5 |
1,0 |
1,197 |
1,961 |
1,582 |
1,157 |
0,485 |
0,625 |
1,047 |
1,462 |
|
|
Среднее |
1,0 |
1,280 |
1,804 |
1,557 |
1,143 |
0,522 |
0,631 |
1,110 |
1,439 |
|
|
Сред. отклонение |
0,0 |
0,049 |
0,063 |
0,069 |
0,045 |
0,016 |
0,019 |
0,069 |
0,065 |
|
|
% отклонения |
0,0 |
3,8 |
3,5 |
4,4 |
3,9 |
3,0 |
3,0 |
6,2 |
4,5 |
|
|
ПП - 4 №6 |
|
|||||||||
|
1 |
1547 |
1693 |
2090 |
1903 |
1656 |
1276 |
1358 |
1618 |
1845 |
1003 |
|
2 |
1863 |
2120 |
2917 |
2333 |
2029 |
1468 |
1552 |
2140 |
2400 |
1049 |
|
3 |
1460 |
1661 |
1830 |
1699 |
1517 |
1250 |
1304 |
1518 |
1669 |
1028 |
|
4 |
1637 |
1775 |
2209 |
2032 |
1806 |
1535 |
1580 |
1826 |
1988 |
1194 |
|
5 |
1975 |
2137 |
2754 |
2407 |
2092 |
1547 |
1645 |
2316 |
2524 |
1088 |
|
Относительная оценка
величины пиков |
|
|||||||||
|
1 |
1,0 |
1,3 |
2,0 |
1,7 |
1,2 |
0,5 |
0,7 |
1,1 |
1,5 |
|
|
2 |
1,0 |
1,3 |
2,3 |
1,8 |
1,2 |
0,5 |
0,6 |
1,3 |
1,7 |
|
|
3 |
1,0 |
1,6 |
2,0 |
1,7 |
1,2 |
0,6 |
0,7 |
1,2 |
1,6 |
|
|
4 |
1,0 |
1,3 |
2,3 |
1,9 |
1,4 |
0,6 |
0,8 |
1,4 |
1,8 |
|
|
5 |
1,0 |
1,2 |
1,9 |
1,5 |
1,1 |
0,5 |
0,6 |
1,3 |
1,6 |
|
|
Среднее |
1,0 |
1,332 |
2,093 |
1,702 |
1,228 |
0,538 |
0,678 |
1,284 |
1,644 |
|
|
Сред. отклонение |
0,0 |
0,100 |
0,160 |
0,115 |
0,061 |
0,032 |
0,054 |
0,085 |
0,065 |
|
|
% отклонения |
0,0 |
7,5 |
7,6 |
6,8 |
5,0 |
5,9 |
7,9 |
6,6 |
4,0 |
|
Как видно из таблицы 1, доля максимальных
отклонений по результатам количественной оценки уровня амплификации изученных
образцов не превысила 10 %, что является допустимой технологической
погрешностью метода.
На следующем этапе исследований был
проведен SSR– анализ 20 образцов. Результаты представлены в таблице 2.
Таблица 2.
Данные о плоидности образцов березы на
основании анализа микросателлитных
спектров
|
№ п/п |
Образец |
PTR5 |
PTR 6 |
PTR 8 |
PTR 12 |
Уровень плоидности
доминирующего числа клеток |
Уровень миксоплоидии образца |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
1 |
пп-3 №5 |
188 |
258 |
133/136/141 |
259 |
Триплоид |
15% |
|
2 |
пп-3 №6 |
188 |
256 |
133/136/141 |
258 |
Триплоид |
16% |
|
3 |
пп-3 №14 |
188 |
256 |
133/136/141 |
258 |
Триплоид |
18% |
4 |
пп-4 №1 |
188 |
256,256/263 |
135 |
258 |
Триплоид |
12% |
|
5 |
пп-4 №6 |
188 |
256,256/263 |
135 |
258 |
Триплоид |
14% |
|
6 |
пп-5 №2 |
188 |
250/256 |
141/143 |
258/262 |
Диплоид |
22% |
|
7 |
пп-5 №3 |
188 |
250/256 |
141/143 |
258/262 |
Диплоид |
18% |
|
8 |
пп-5 №6 |
188 |
250/256 |
141/143 |
258/262 |
Диплоид |
24% |
|
9 |
пп-6 №1 |
188 |
256/262 |
136/143 |
258 |
Диплоид |
15% |
|
10 |
пп-6 №4 |
188 |
256/262 |
136/143 |
258 |
Диплоид |
12% |
11 |
пп-6 №9 |
188 |
256/262 |
136/143 |
258 |
Диплоид |
10% |
|
12 |
пп-8 №3 |
188 |
256,256/264 |
136/141,141 |
258 |
Триплоид |
24% |
|
13 |
пп-8 №5 |
188 |
256,256/264 |
136/141,141 |
258 |
Триплоид |
21% |
|
14 |
пп-8 №10 |
188 |
256,256/264 |
136/141,141 |
258 |
Триплоид |
20% |
|
15 |
№8 биляр |
188 |
256,256/263 |
135 |
258 |
Триплоид |
23% |
|
16 |
35f 11 №27 |
188 |
257 |
133/141 |
258 |
Диплоид |
7% |
|
17 |
35f2 №1 в. |
188 |
250/256 |
141/143 |
258 |
Диплоид |
6% |
|
18 |
35f2 №1т.г. |
188 |
250/256 |
141/143 |
258 |
Диплоид |
9% |
|
19 |
35f11 п. |
188 |
250/256,256 |
134/138/141 |
258/267/267 |
Триплоид |
14% |
|
20 |
35f11 т.г. |
188 |
257 |
133/141 |
258 |
Диплоид |
5% |
Следует отметить, что в таблице 2 представлены результаты анализа по
локусам, представленных в гетерозиготном состоянии и характеризующиеся
отсутствием артефактных зон амплификации.
Как указывалось ранее, проведение анализа на основании интерпретации
мономорфных спектров является невозможным. Кроме того, в ряде случаев дисбаланс
в уровне амплификации аллельных вариантов был связан с аномалиями определенной
хромосомы, что выражалось в достоверном варьировании аллельных ПЦР-спектров по
одному локусу, при неизменности результатов амплификации по другим изучаемым SSR-
маркерам. Образцы, для которых количественная вариация уровня амплификации выявлялась по нескольким локусам,
определялись как генотипы с наличием миксоплоидии. Установление характера
кариологических аномалий для данных образцов является возможным только в случае
анализа каждой группы сцепления (хромосомы) с помощью дополнительного набора
полиморфных SSR– маркеров.
На территории
Сабинского лесничества Министерства лесного хозяйства Республики Татарстан в
течение 4-х лет нами выращиваются первые в республике опытные генотипы плюсовой
осины, размноженной в условиях in vitro.
В феврале 2007 года между СПбНИИЛХ и факультетом
лесного хозяйства и экологии КазГАУ был заключен договор о выращивании
регенерантов осины для дальнейшего их укоренения в условиях Республики
Татарстан.
В качестве первичного экспланта были
использованы почки с молодых побегов устойчивых к сердцевинной гнили клонов
осины № 34 и 35, выращенных в тремулетуме Костромской ЛОС (Багаев, Багаев,
1990). Клон № 34 – диплоид f 2, а № 35 – триплоид f
11.
Весной 2007 года на территории дендрария ГБУ
«Сабинский учебно-опытный лесхоз» заложен опыт по выращиванию саженцев осины из
регенерантов, полученных методом in vitro с последующей их
высадкой в открытый грунт (Газизуллин и др., 2007).
На территории дендрария
Сабинского учебно-опытного лесхоза была установлена теплица и заложен опыт по
изучению способов доращивания саженцев осины из регенерантов, полученных по
технологии in vitro.
Литература:
1.
Багаев,
С.Н. Генетический резерват осины исполинской / С.Н. Багаев, Е.С.Багаев// Лесное
хозяйство. - № 1990. - № 4. – С. 45-48.
2. Газизуллин, А.Х. Опыт
выращивания осины из регенерантов, полученных по технологии in vitro в Сабинском лесхозе РТ /
А.Х. Газизуллин, Н.М. Ятманова, А.С. Пуряев, З.Г. Хакимова, Г.А. Петрова //
Леса, лесной сектор и экология Республики Татарстан: сб. научн. статей.–
Казань: Школа, 2007– Вып.3. – С. 75 – 81.
3.
Газизуллин,
А.Х. Результаты обследования осинников Западного Закамья Республики Татарстан
на наличие быстрорастущих, здоровых элитных клонов для размножения методами
биотехнологии / А.Х. Газизуллин, А.С. Пуряев, Ш.Х. Исмагилов, З.Г. Хакимова,
Р.И. Исмагилов, В.И. Чернов, И.И. Гимадеев, Д.И. Зарипов, Н.Р. Гарипов //Леса,
лесной сектор и экология Республики Татарстан: сб. научн. статей.– Казань:
Школа, 2007– Вып.3. – С. 64 – 75.